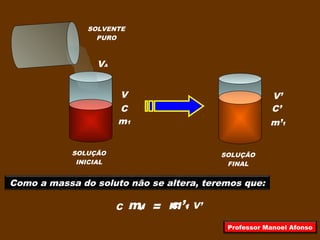
1) O documento descreve diferentes tipos de misturas e soluções, incluindo misturas homogêneas, heterogêneas, dispersões, soluções e os termos associados como solvente, soluto e coeficiente de solubilidade.
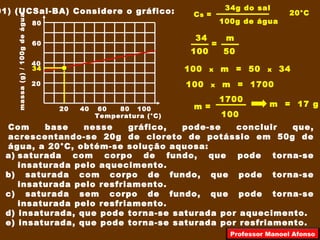
2) São apresentados exemplos de como calcular a quantidade máxima de um soluto que pode se dissolver em um solvente usando o coeficiente de solubilidade.
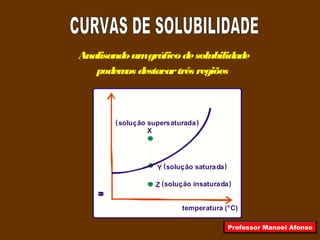
3) São definidos os tipos de soluções como insaturada, saturada e supersaturada em relação à quantidade de soluto dissolvido.