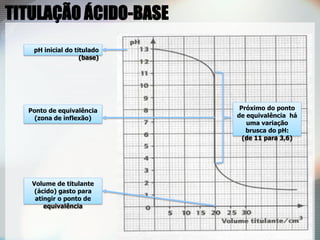
O documento discute titulações ácido-base, especificamente:
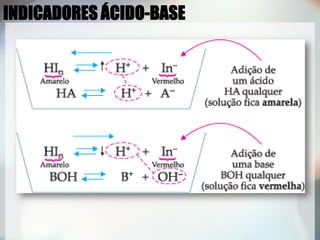
1) Ácidos e bases fortes dissociam-se completamente em solução aquosa, permitindo equações químicas estequiométricas;
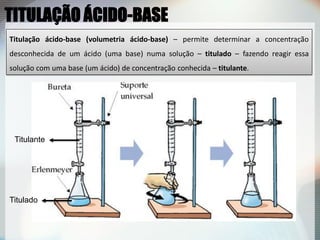
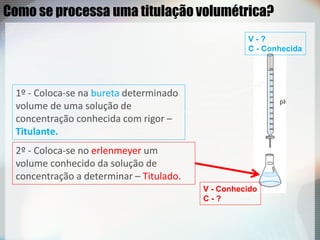
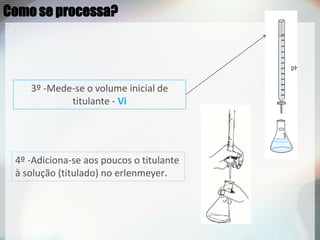
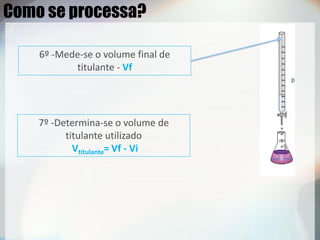
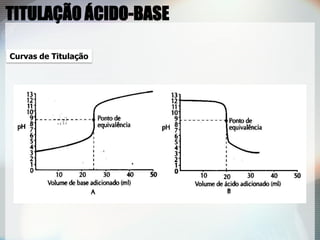
2) Uma titulação ácido-base envolve a adição de uma solução de concentração conhecida até o ponto de equivalência, quando as quantidades de ácido e base são estequiométricas;
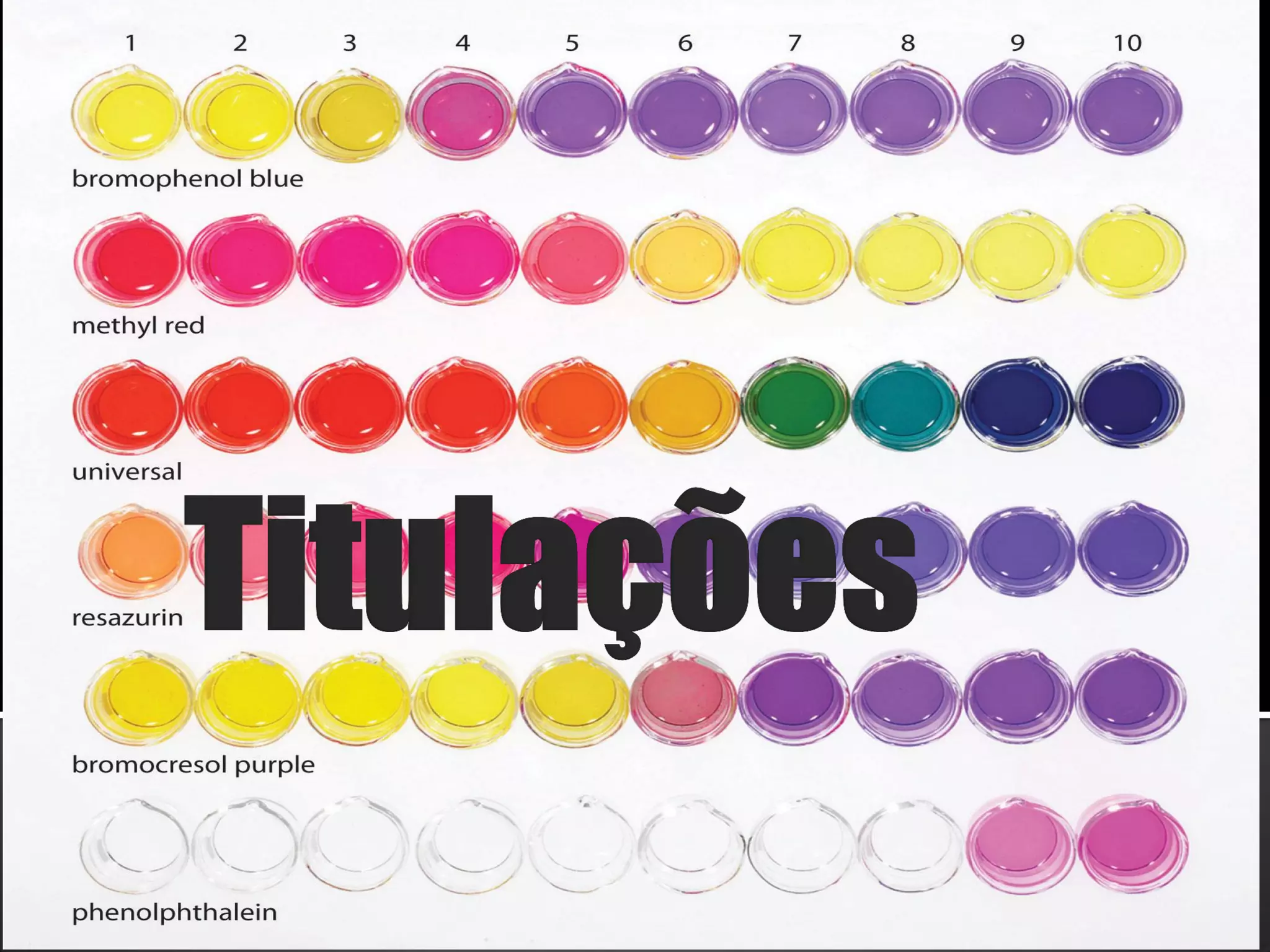
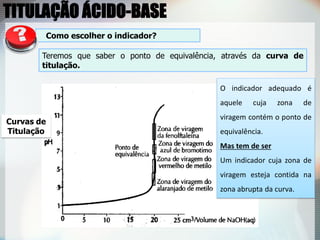
3) Indicadores visuais são usados para detectar o ponto final da titulação, que deve ser próximo do ponto de equivalência.











![EXERCÍCIO
Observe a seguinte figura e determine a concentração de HCl desconhecida, presente no
titulado.
R:
[NaOH]= 0,1 mol dm-3
VNaOH gasto = 10 mL = 0,01dm3
[HCl]= ? mol dm-3
VHCl = 25 mL = 0,025 dm3
Como estequiometria 1: 1
na= nb Ca Va = Cb Vb
Ca 0,025 = 0,1 0,01
Ca = 0,04 mol dm-3
)(2)()()( laqaqaq OHNaClNaOHHCl ](https://image.slidesharecdn.com/7-titulacoes-140509033224-phpapp01/85/7-titulacoes-20-320.jpg)

![EXERCÍCIO
R:
a)
b) Estequiometria 1:1. Resultado: Ca= 0,05 mol dm-3
c) O pH no ponto de equivalência é 7 (a 25 ºC). No ponto de equivalência existe a
solução de um sal derivado de um ácido forte e de uma base forte. Como os iões
deste sal não sofrem hidrólise, a solução é neutra.
d) nb = cb Vb nb = 0,10 4,00 10-3 nb = 4,00 10-4 mol
na = ca Va na = 0,05 20,00 10-3 nb = 10 10-4 mol
Nesta altura existe excesso de ácido forte de 6 10-4 mol num volume de 24,00
cm3. A sua concentração é 0,025 mol dm-3.
Calculo do pH da solução de HNO3, 0,025 mol dm-3.
[H3O+]= [HNO3] ionizado= 0,025 mol dm-3
pH = - log [H3O+]= - log (0,025) pH = 1,6
)(2)(3)()(3 laqaqaq
OHNaNONaOHHNO ](https://image.slidesharecdn.com/7-titulacoes-140509033224-phpapp01/85/7-titulacoes-22-320.jpg)