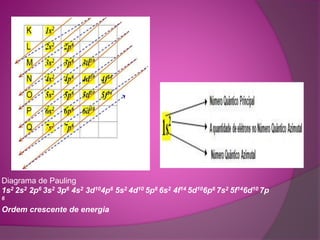
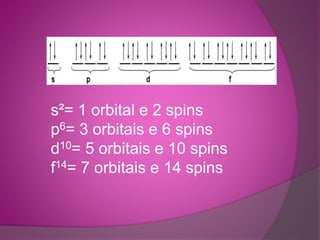
O documento descreve o diagrama de Pauling, um método para distribuir elétrons nos átomos e íons de acordo com sua energia crescente. Foi desenvolvido por Erwin Madelung, embora muitas vezes seja atribuído incorretamente a Linus Pauling. Explica como os elétrons saltam entre camadas ao receber energia e emitem luz ao retornar.