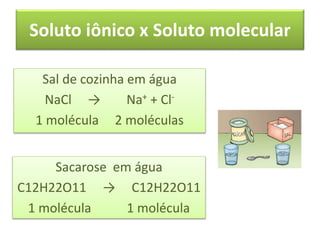
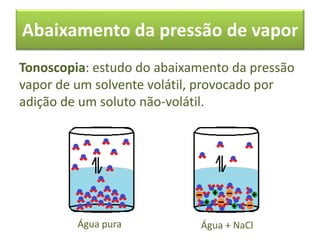
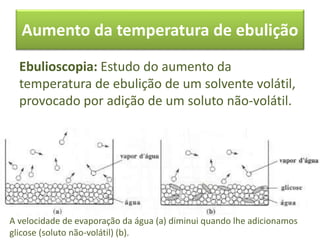
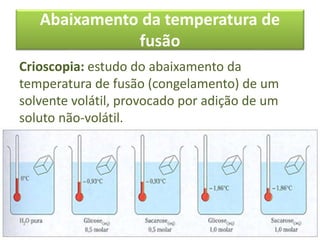
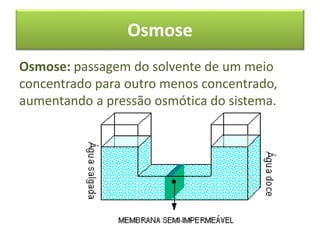
As propriedades coligativas de soluções são abordadas, incluindo o abaixamento da pressão de vapor, aumento da temperatura de ebulição e abaixamento da temperatura de congelamento quando solutos não voláteis são adicionados a solventes. O documento discute as diferenças entre solutos iônicos e moleculares e fornece exemplos de tonoscopia, ebulioscopia e crioscopia.