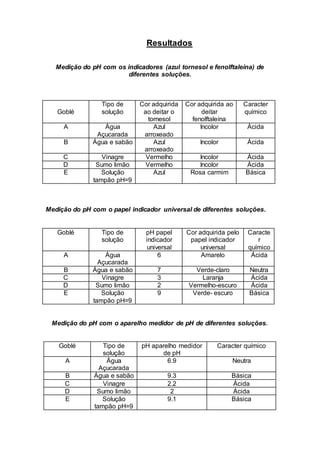
Este relatório descreve experimentos realizados para medir o pH de diferentes substâncias usando indicadores de pH e um medidor de pH. Os alunos mediram o pH de soluções como água açucarada, vinagre e sumo de limão usando papel indicador universal, indicadores de tornassol e fenolftaleína e um medidor de pH, registrando os resultados em tabelas.