Incorporar apresentação
Baixado 207 vezes


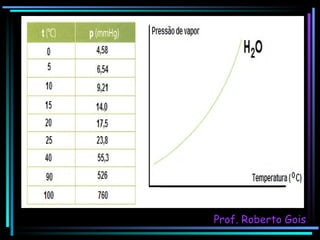
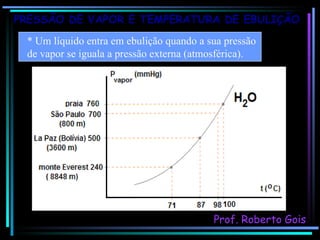
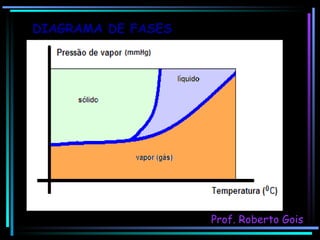

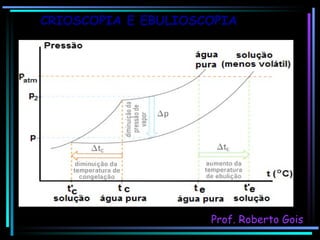
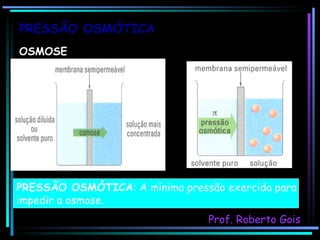



O documento discute as propriedades coligativas, que são as variações nas propriedades físicas de um solvente quando um soluto não volátil é adicionado. Aborda conceitos como pressão de vapor, temperatura de ebulição, crioscopia, ebulioscopia, tonoscopia e pressão osmótica, e explica como esses efeitos dependem da quantidade de partículas dissolvidas na solução.









