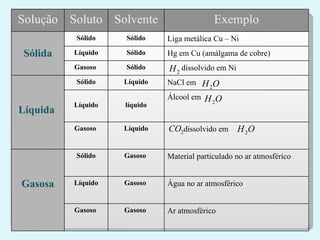
O documento discute diferentes tipos de soluções, incluindo:
1) Soluções iônicas e moleculares;
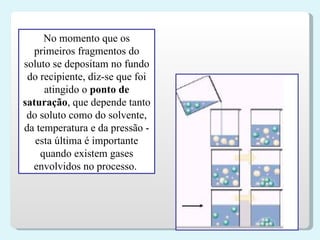
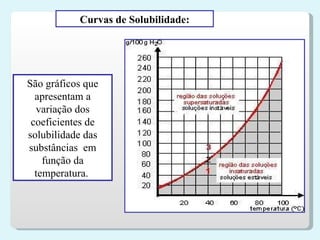
2) Classificação de soluções de acordo com a relação entre soluto e solvente, como saturadas e não saturadas;
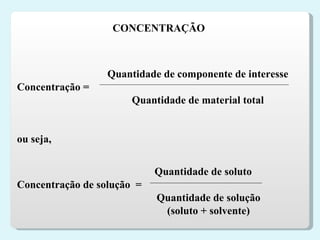
3) Concentração de soluções e formas de expressá-la, como gramas por litro e porcentagem.