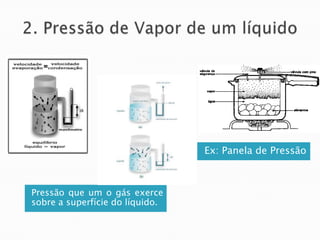
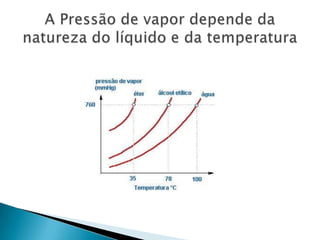
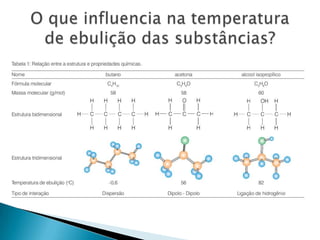
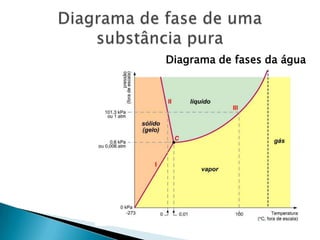
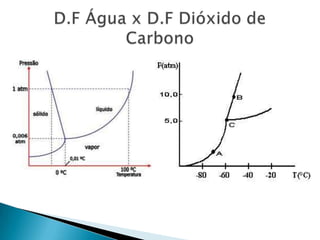
1) O documento discute propriedades de substâncias químicas e suas temperaturas de ebulição sob diferentes pressões.
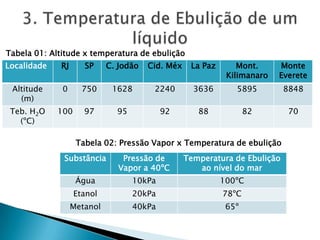
2) Apresenta tabelas mostrando a relação entre altitude, pressão atmosférica e temperatura de ebulição da água.
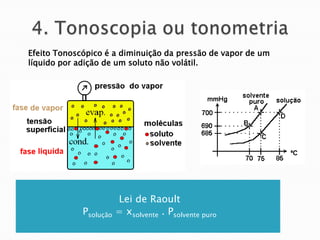
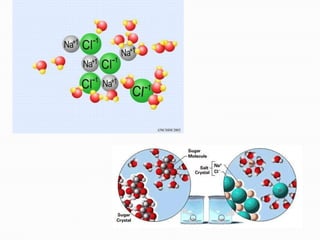
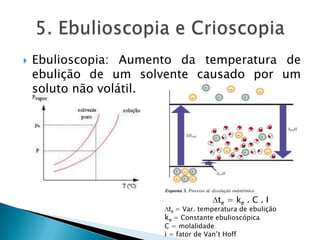
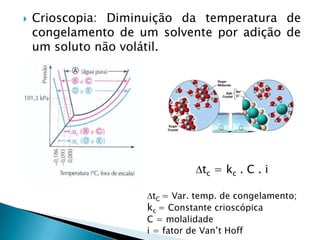
3) Explica propriedades coligativas de soluções como tonoscopia, ebulioscopia e crioscopia.