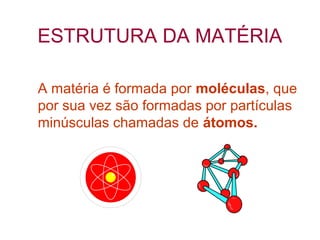
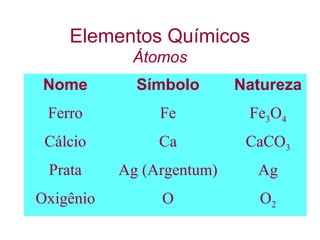
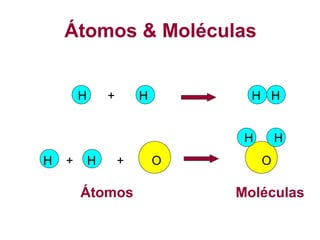
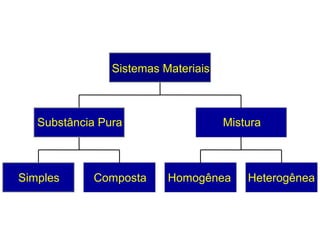
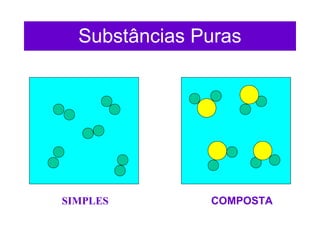
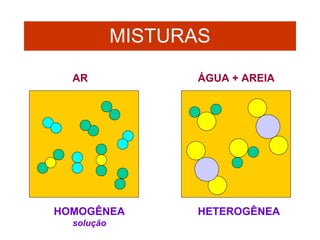
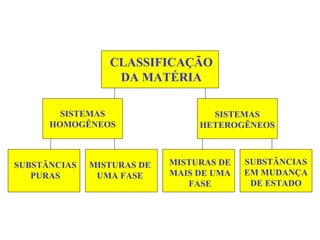
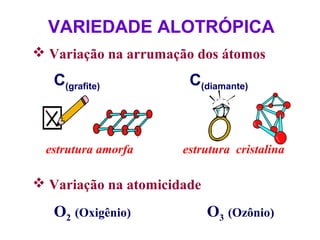
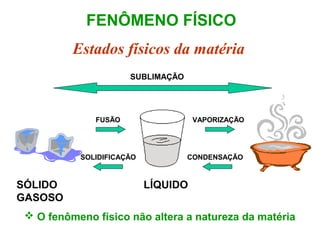
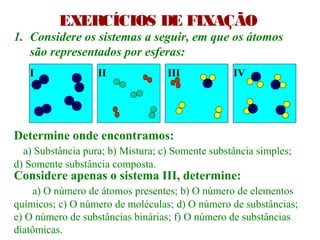
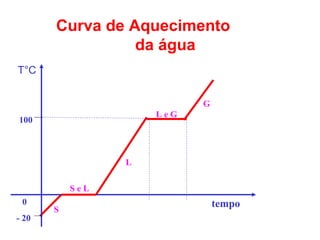
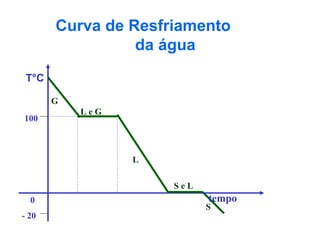
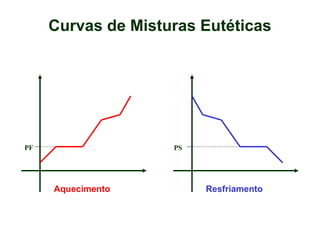
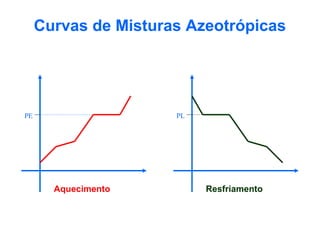
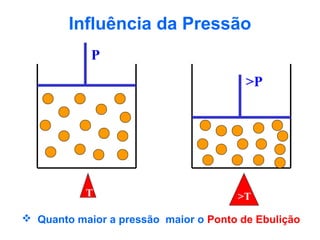
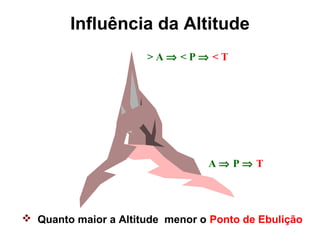
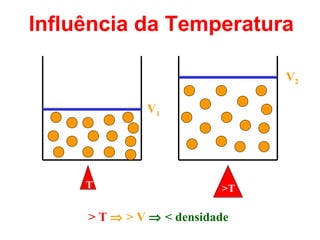
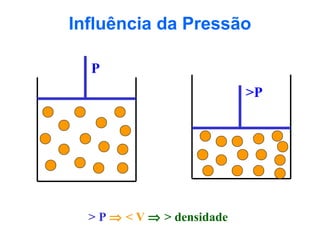
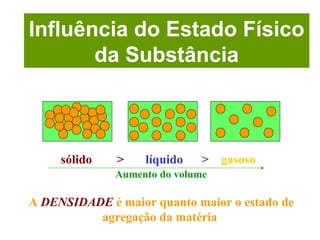
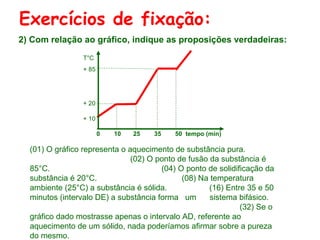
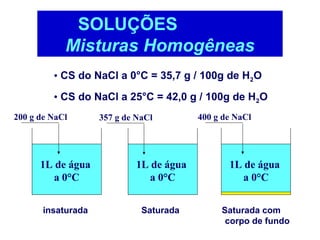
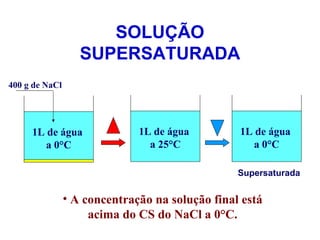
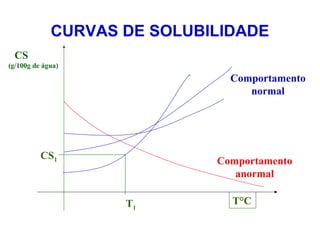
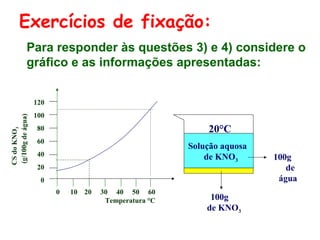
O documento apresenta conceitos básicos da Química, incluindo: (1) a definição de Química como ciência experimental que estuda a estrutura, composição e transformação da matéria; (2) a estrutura da matéria formada por átomos e moléculas; (3) os diferentes tipos de sistemas materiais como substâncias puras, misturas e suas classificações.