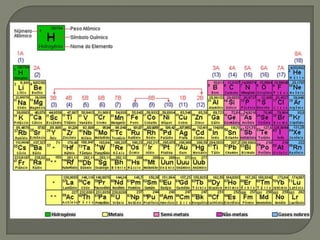
O documento discute conceitos fundamentais de estequiometria como:
1) Leis das reações químicas e balanceamento de equações;
2) Conceitos de mol, massa atômica, massa molecular e massa molar;
3) Cálculos estequiométricos utilizando leis químicas e regra de três.