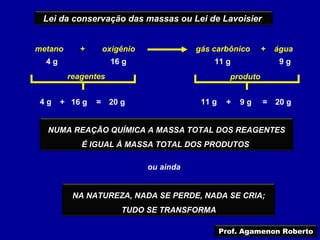
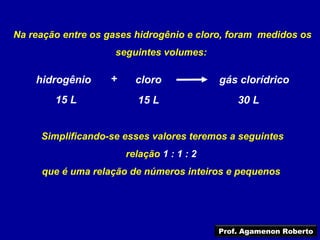
O documento descreve as principais leis das reações químicas, divididas em leis ponderais e leis volumétricas. As leis ponderais incluem a conservação da massa e as proporções constantes e múltiplas nas reações. As leis volumétricas descrevem as proporções entre os volumes dos gases que reagem e se formam.