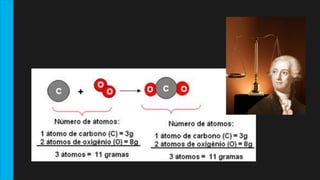
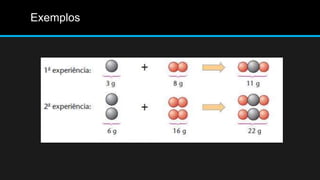
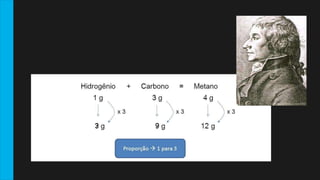
Este documento descreve as Leis de Lavoisier e Proust, que fundamentaram a Química Moderna. A Lei de Lavoisier estabelece que a massa total é conservada em uma reação química, enquanto a Lei de Proust estabelece que as proporções de massa dos elementos em um composto são sempre constantes. O documento fornece exemplos e detalhes sobre como essas leis foram descobertas e seu significado para a química.