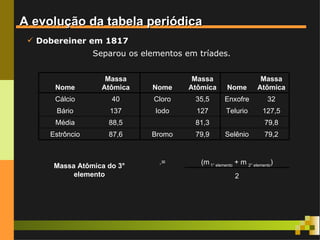
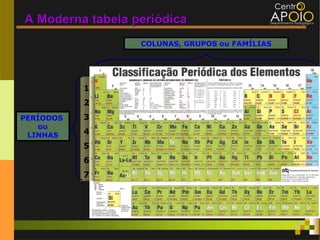
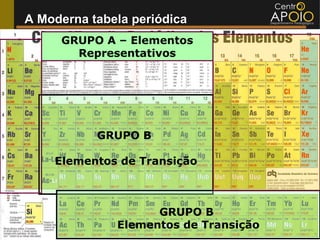
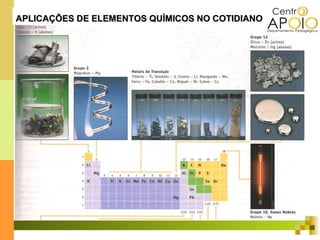
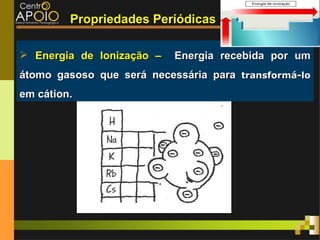
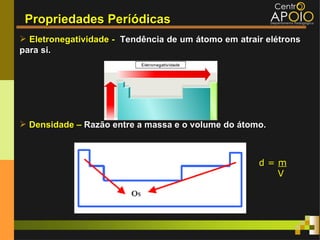
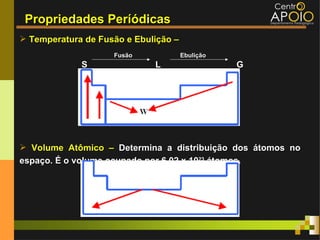
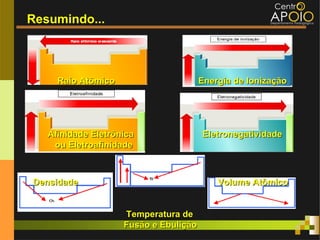
O documento aborda o desenvolvimento histórico da tabela periódica, suas relações com a estrutura atômica e as propriedades químicas e físicas dos elementos. Destaca as contribuições de cientistas como Dobereiner, Newlands, Mendeleev e Moseley na organização dos elementos. Também menciona propriedades periódicas como raio atômico, energia de ionização e eletronegatividade, além de aplicações práticas dos elementos químicos no cotidiano.