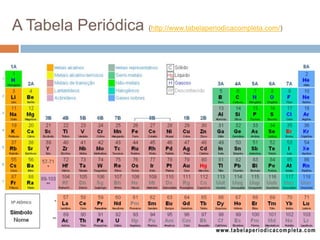
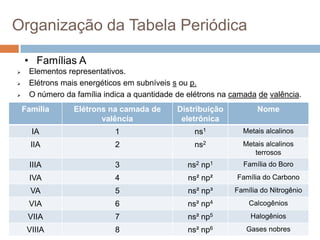
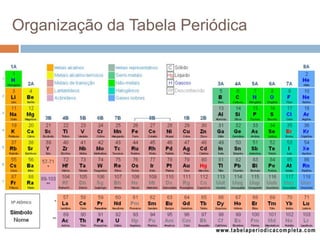
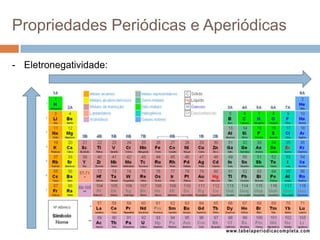
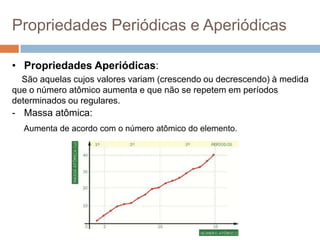
O documento discute a história da tabela periódica, como foi desenvolvida ao longo do tempo por diferentes cientistas. Apresenta também como a tabela periódica é organizada em grupos e períodos, e como isso reflete as propriedades periódicas e aperiódicas dos elementos, como raio atômico, energia de ionização e eletronegatividade.