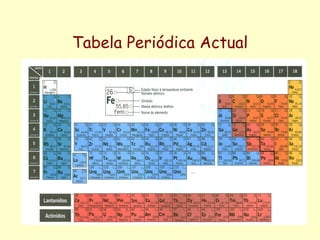
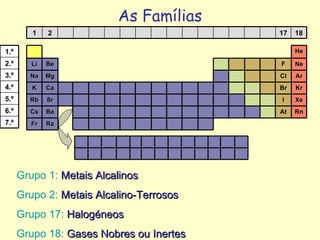
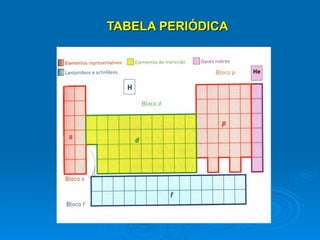
A Tabela Periódica evoluiu ao longo do tempo com a descoberta de novos elementos químicos e o estabelecimento de relações periódicas entre suas propriedades. Cientistas como Dobereiner, Newlands, Meyer, Mendeleiev e Moseley contribuíram para a organização dos elementos de acordo com suas propriedades através de leis e tabelas periódicas, permitindo prever propriedades de elementos ainda não descobertos. A tabela atual organiza os elementos por número atômico crescente em 18 grupos e 7 períodos.