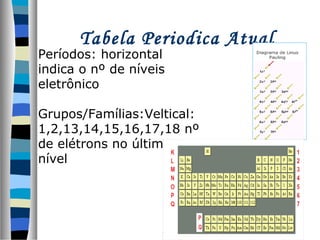
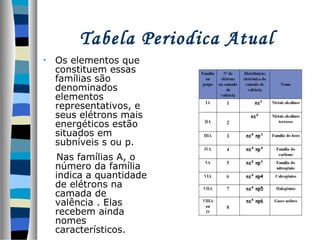
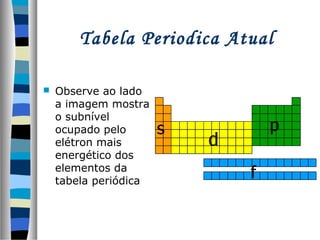
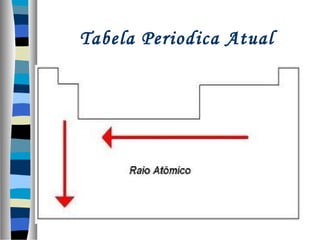
Este documento descreve as contribuições de vários cientistas para a construção da tabela periódica, incluindo:
1) Antoine Lavoisier, que sistematizou as primeiras observações químicas e construiu uma tabela com 32 elementos em 1789;
2) J.W. Döbereiner, que organizou elementos em grupos de três com propriedades semelhantes ("tríades") em 1829;
3) Dimitri Mendeleyev, que desenvolveu a primeira tabela periódica completa em 1869, deixando espaços