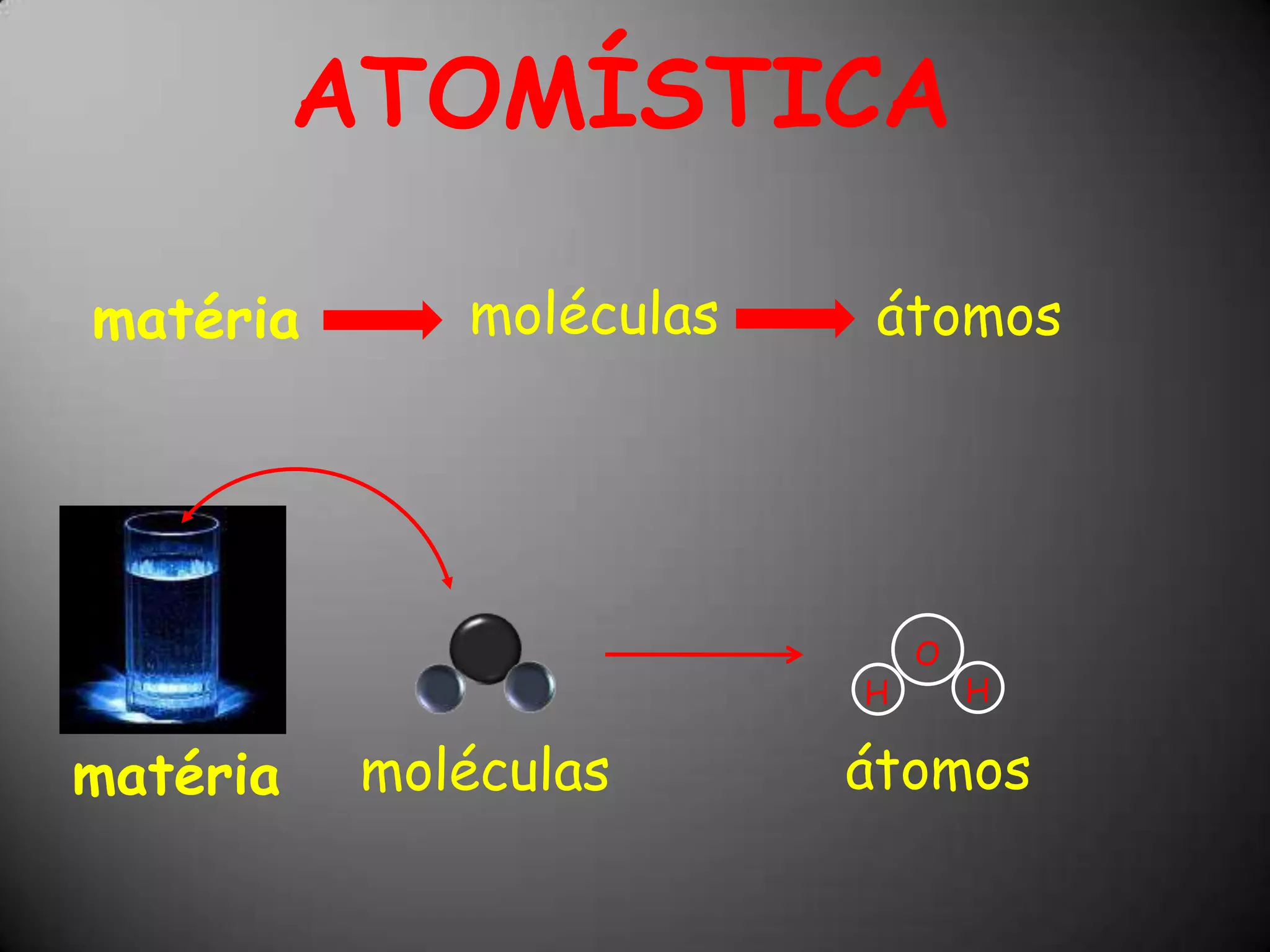
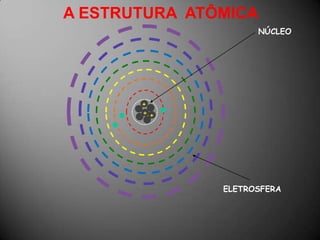
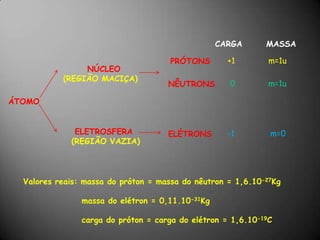
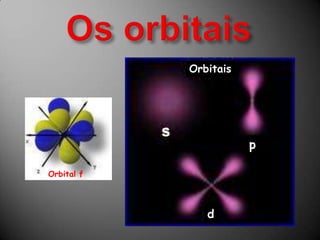
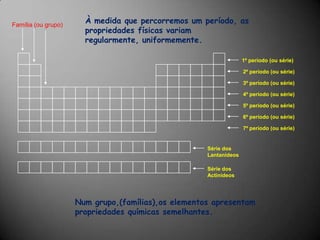
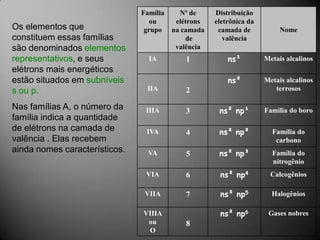
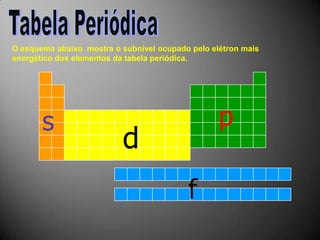
O documento discute a estrutura atômica, incluindo o núcleo, elétrons e prótons, e como esses componentes se relacionam com a formação de cátions, ânions e isótopos. Também explica a organização periódica dos elementos na tabela periódica de acordo com suas propriedades.