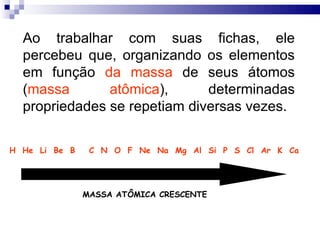
1) O documento descreve a classificação periódica dos elementos química desenvolvida por Mendeleev em 1869.
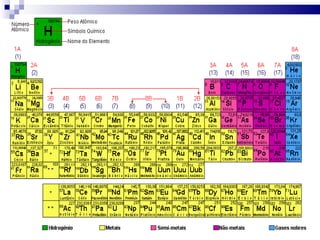
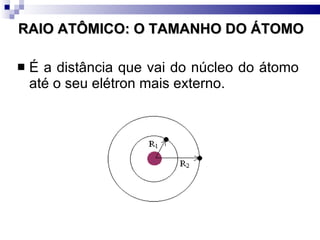
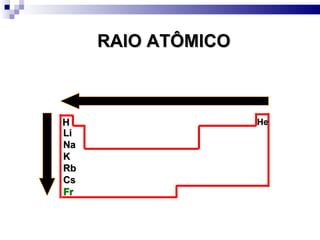
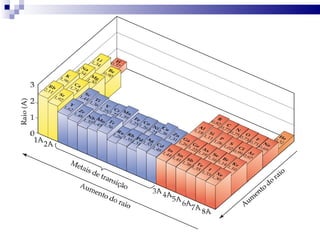
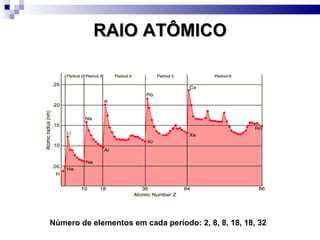
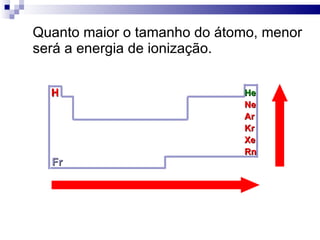
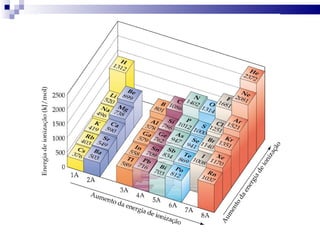
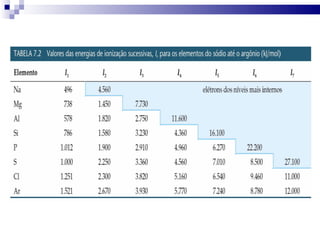
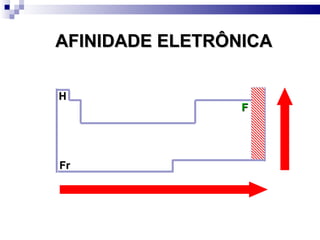
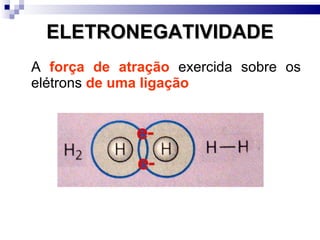
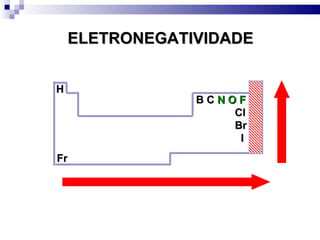
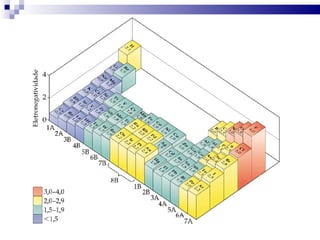
2) A tabela periódica organiza os elementos de acordo com seu número atômico e propriedades periódicas como raio atômico e energia de ionização.
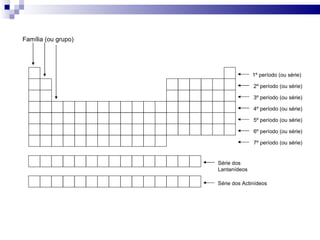
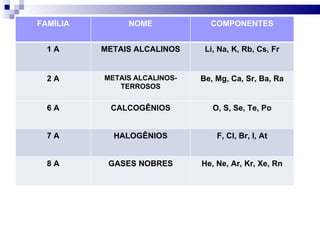
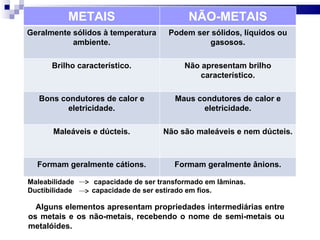
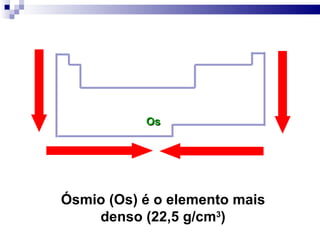
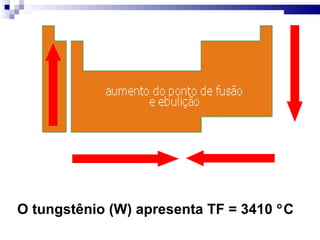
3) A tabela agrupa elementos em famílias com propriedades químicas semelhantes e períodos com base no número de camadas eletrônicas.