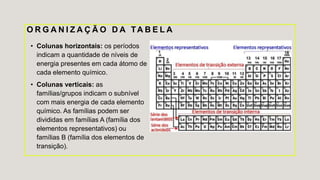
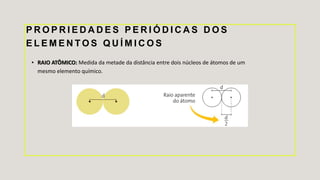
O documento descreve a história da tabela periódica, como foi organizada inicialmente por Mendeleiev e posteriormente reorganizada por Moseley com base no número atômico. Explica também as características dos elementos químicos, como são organizados e classificados na tabela periódica, e como variam propriedades como raio atômico, energia de ionização e eletronegatividade.