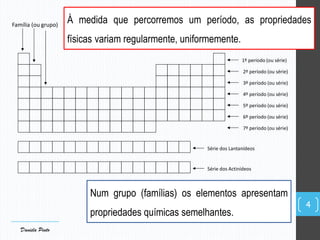
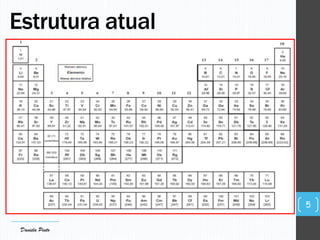
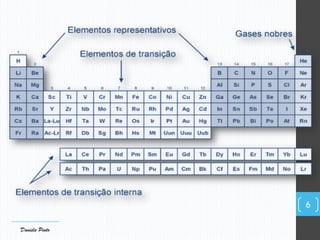
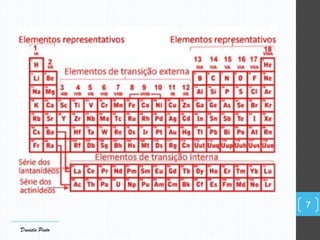
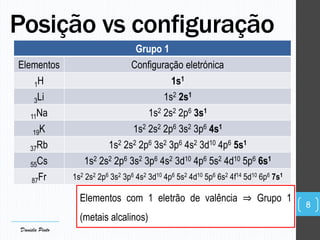
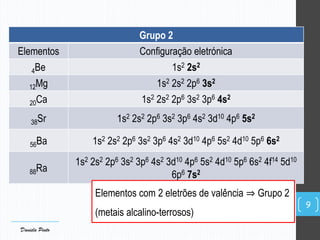
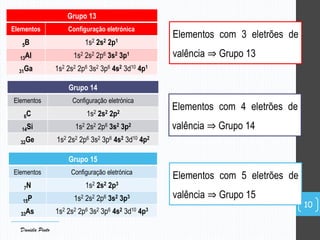
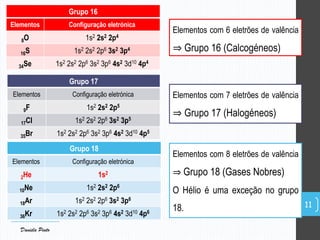
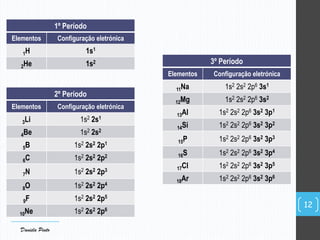
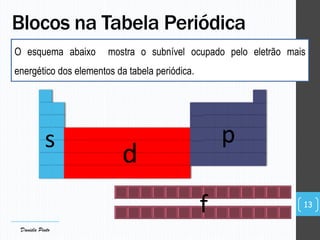
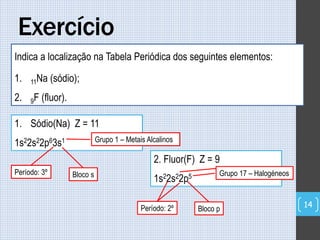
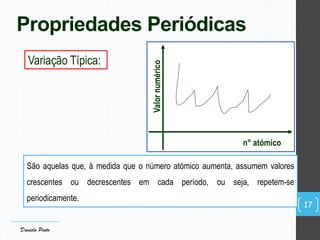
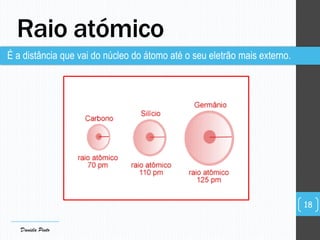
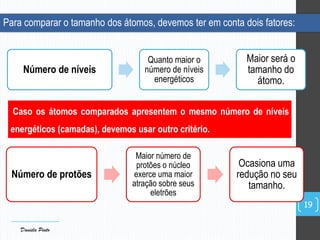
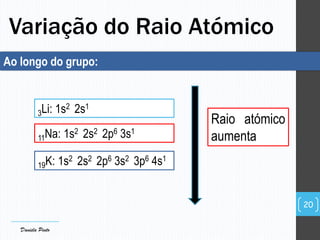
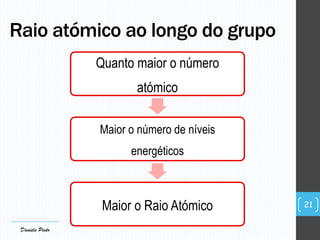
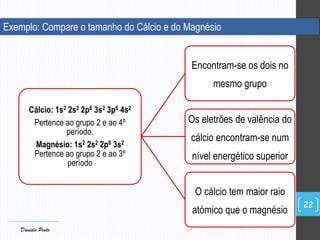
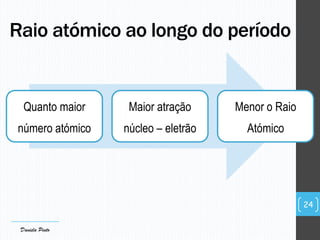
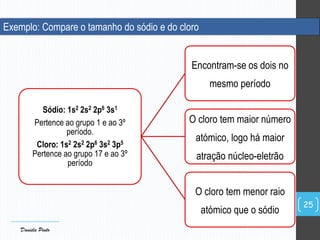
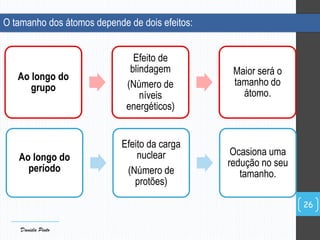
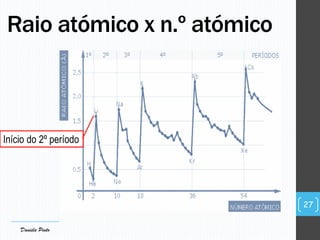
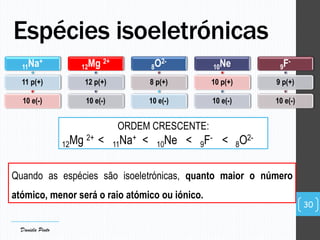
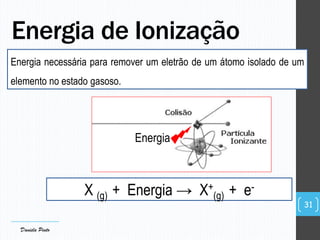
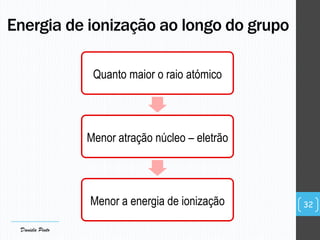
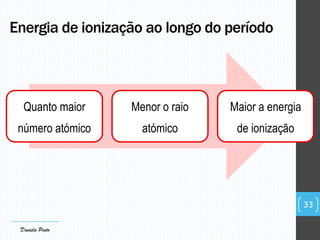
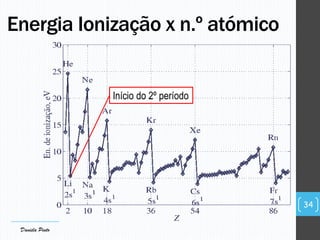
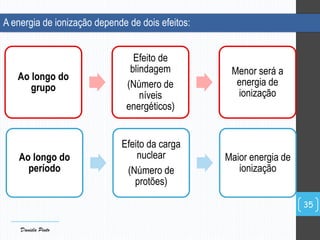
O documento descreve a organização periódica dos elementos químicos realizada por Dmitri Mendeleev em 1869, listando e organizando os cerca de 60 elementos químicos conhecidos na época de acordo com suas propriedades. Mendeleev dispôs os elementos em ordem crescente de massa atômica, estabelecendo as bases para a Tabela Periódica dos Elementos.