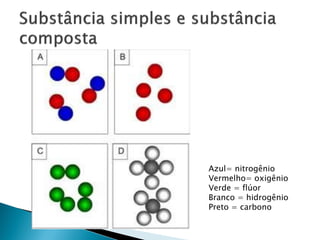
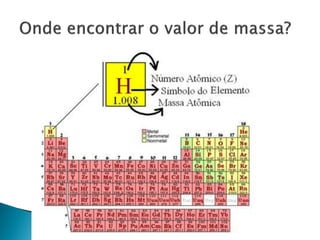
O documento discute conceitos fundamentais de molécula, átomo, massa atômica, quantidade de matéria (mols) e suas aplicações em cálculos químicos. Explica que uma molécula é composta por pelo menos dois átomos e apresenta exemplos de fórmulas químicas.