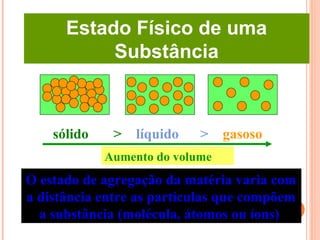
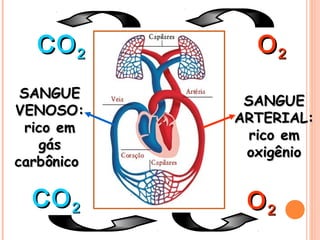
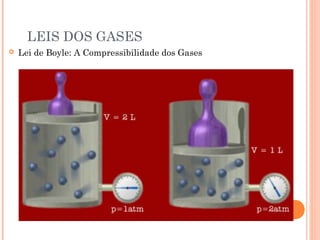
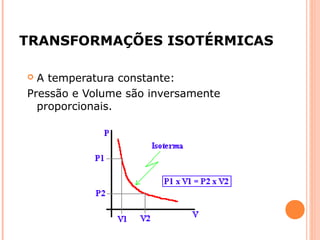
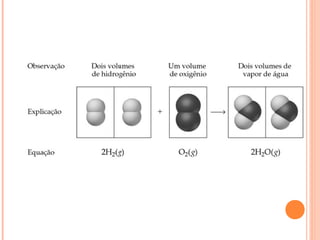
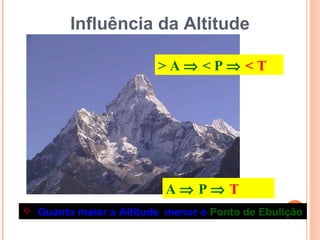
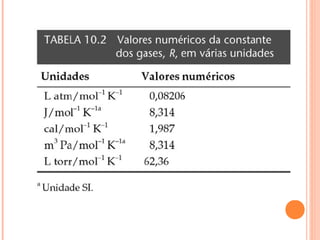
Este documento discute as propriedades dos gases e as leis que os regem. Resume as três principais leis dos gases - a Lei de Boyle, a Lei de Charles e a Lei de Avogadro - e como elas podem ser combinadas na Equação do Gás Ideal. Também discute a Teoria Cinética dos Gases e como ela explica o comportamento macroscópico dos gases a nível molecular.