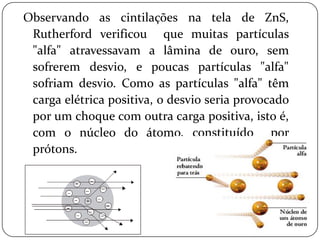
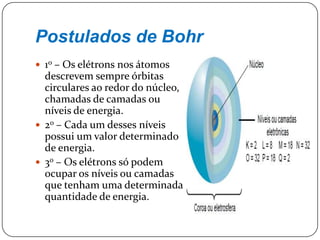
O documento descreve a evolução do conceito e modelo atômico ao longo da história, começando pelas primeiras ideias de Demócrito no século V a.C de que a matéria é constituída por partículas indivisíveis, passando pelos modelos de Dalton, Thomson, Rutherford e Bohr, até chegar ao modelo atômico clássico atual com núcleo e elétrons.