O documento discute os conceitos de equilíbrio ácido-base, definindo ácidos, bases e suas propriedades. Explica os cálculos de pH e pOH em diferentes soluções, como ácido acético, acetato de sódio e cloreto de amônio. Fornece exemplos do cálculo de pH em soluções tampão.





![EQUÍLIBRIO ÁCIDO-BASE
CÁLCULO DAS CONSTANTES:
- Ácidos e bases fracas
- A constante de ionização do ácido HA é dada pela expressão:
A constante de ionização da base A-, conjugada do ácido HA é obtida do equilíbrio:
[H3O+] [A-] [HA] [OH-]
Ka Kb = ----------------- ----------------- = [H3O+] [OH-]
[HA] [A-]](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-6-320.jpg)
![EQUÍLIBRIO ÁCIDO-BASE
Baseando-se nos valores de [H+] e [OH-], o valor de Kw pode ser calculado:
Kw = 1,0 x 10-7 . 1,0 x 10-7
A uma temperatura de 25ºC: Kw = 1,0 x 10-14
pH e pOH: As relações abaixo representam esses valores:
pH = -log [H+]
pOH = - log [OH-]
A escala de pH é representada por valores de 0 a 14, uma vez que, quanto mais
ácida for a solução, menor será o pH e quanto mais básica for a solução, maior
será o pH.
pH < 7 - solução ácida
pH > 7 - solução básica
pH = pOH = 7 - solução neutra](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-7-320.jpg)









↔1 Na+(aq)+1[CH3COO]-(aq)](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-19-320.jpg)

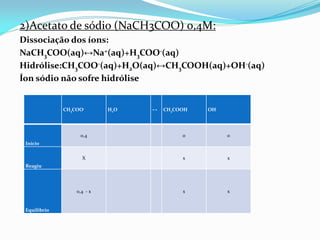
![Ka = 1,8 x 10-5
Kb = 1,8 x 10-5 / 1 x 10-14 >> Ka = 5,6 x 10-10
Kb = [CH3COOH][OH-] / [CH3COO-]
5,6 𝑥 10−10 =
𝑥2
0,4 − x
→ 𝑥2 = 5,6 𝑥 10−10 0,4 → 𝑥
= 1,5 x 10−5
mol
L
(0,4 – x aproximou-se para 0,4. Valor de x < 5%.)
pOH = − log[OH−] = − log[1,5 x 10−5] → pOH = 4,82
Agora o pH:
pH = 14 − pOH = 14 − 4,82 → pH = 9,18](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-24-320.jpg)
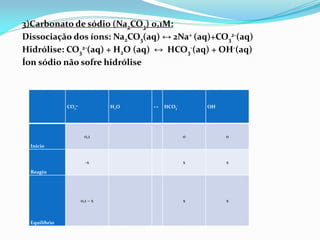
![Ka2 = 5,6 x 10-11
Kb = 5,6 x 10-11 / 1 x 10-14 >> Ka = 1,78 x 10-4
Kb = [HCO3
-][OH-] / [CO3
2-]
1,8 𝑥 10−4
=
𝑥2
0,1 − x
→ 𝑥2
= 1,8 𝑥 10−4
(0,1)
→ 𝑥 = 1,8 x 10−5
mol
L
(0,1 – x aproximou-se para 0,1. x < 5%.)
pOH = − log[4,2 x 10−3] → pOH = 2,4
pH = 14 − pOH = 14 − 2,4 → pH = 11,6](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-26-320.jpg)


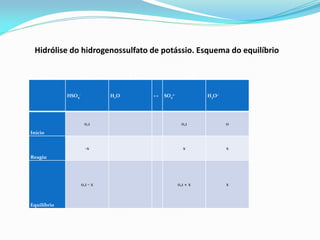
![Ka2 = 1,2 x 10-2
Ka2 = [SO4
2-][H3O+] / [HSO4
-]
1,2 𝑥 10−2 =
𝑥 0,1 + 𝑥
0,1 − x
→ 1,2 𝑥 10−2 = 𝑥
→ pH = 1,92
(0,1 – x aproximado para 0,1. x < 5%.)](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-30-320.jpg)


![8)Cloreto de alumínio (AlCl3) 0,1M:
Dissociação dos íons: AlCl3(aq) ↔ Al3+ (aq) + 3Cl-(aq)
Hidrólise:
[Al(H2O)6]3+(aq)↔[Al(H2O)5(OH)]2+(aq)+H+(aq)
Cloreto não sofre hidrólise
[Al(H2O)6]3+ H2O ↔ H3O+ [Al(H2O)5(OH)]2+
Início
0,1 0 0
Reagiu
x x x
Equilíbrio
0,1 - x x x](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-33-320.jpg)
![Ka = 1,4 x 10-5
Ka = [[Al(H2O)5(OH)]2+][ H3O+] / [[Al(H2O)6]3+]
1,4 𝑥 10−5 =
𝑥2
0,1 − x
→ 𝑥2 = 1,4 𝑥 10−5 0,1
𝑥 → pH = 2,93
(0,5 – x aproximou-se para 0,5)](https://image.slidesharecdn.com/equlibriocido-baseprontocpia-150307123134-conversion-gate01/85/Equilibrio-acido-base-pronto-copia-34-320.jpg)
