1) A aula de química discute reações de esterificação, saponificação e produção de trinitroglicerina;
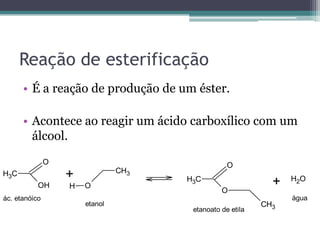
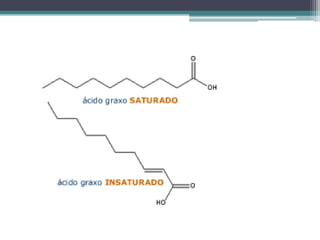
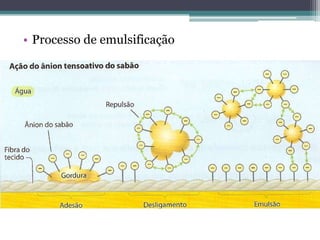
2) A reação de esterificação produz ésteres a partir de ácidos carboxílicos e álcoois, enquanto a saponificação produz sabões;
3) Os sabões e detergentes podem causar impactos ambientais ao formar espumas que impedem a vida aquática quando despejados em rios.