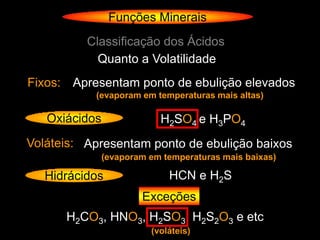
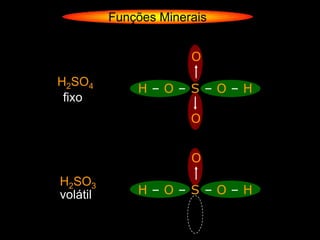
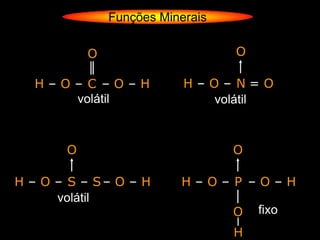
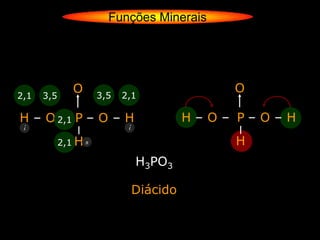
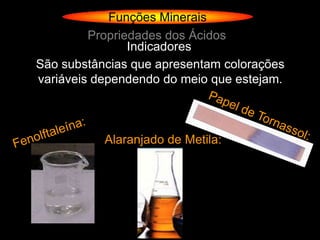
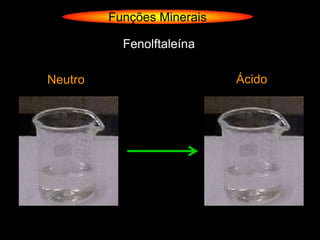
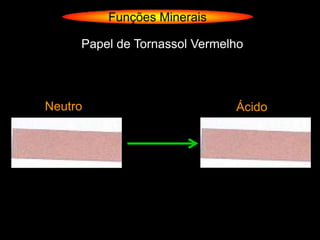
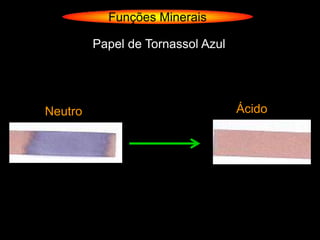
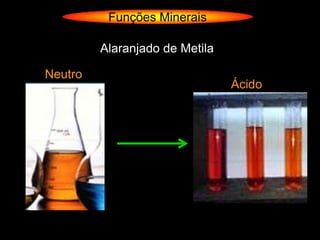
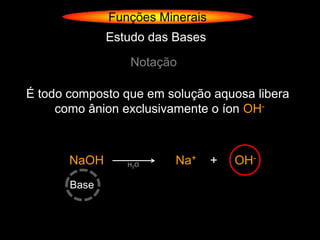
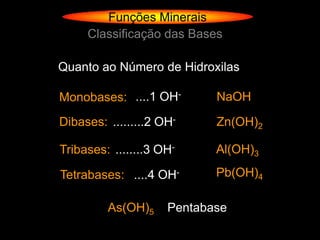
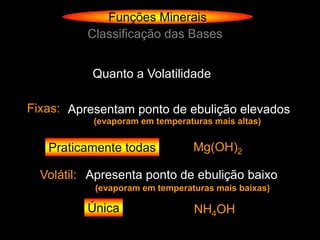
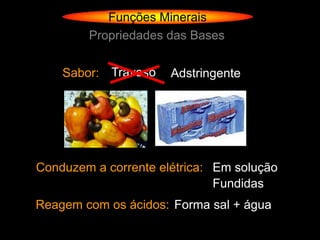
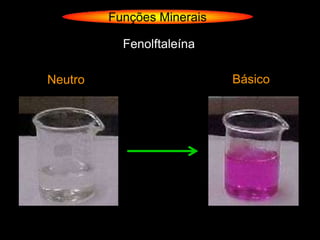
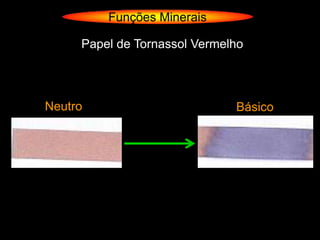
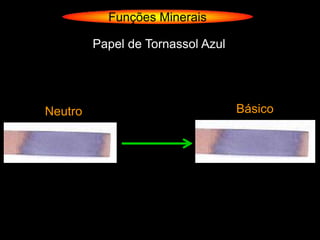
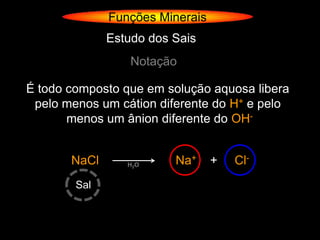
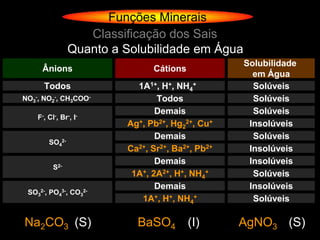
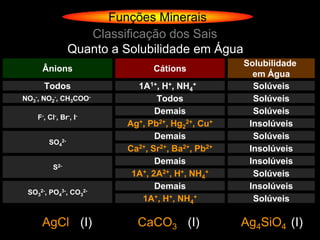
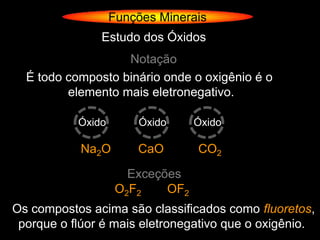
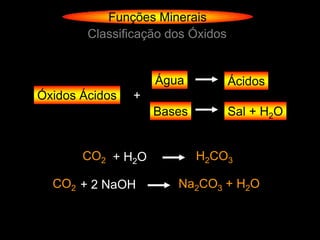
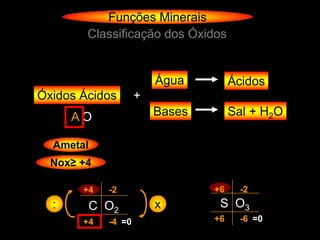
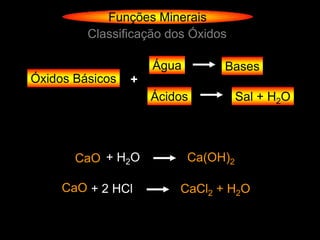
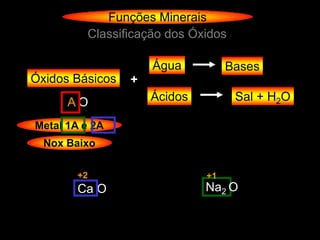
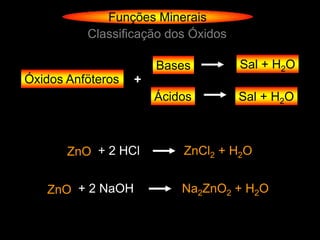
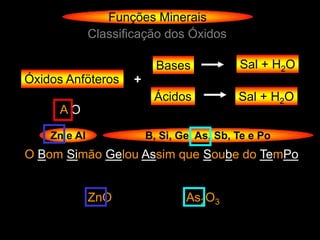
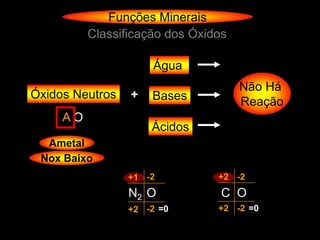
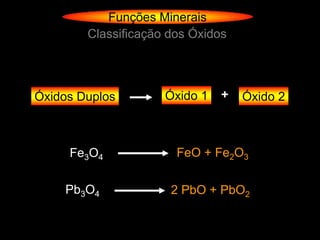
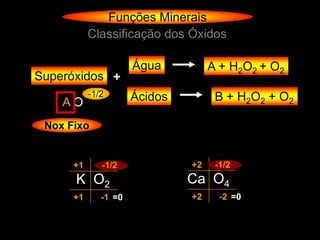
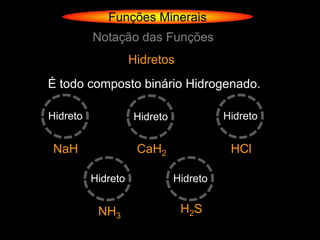
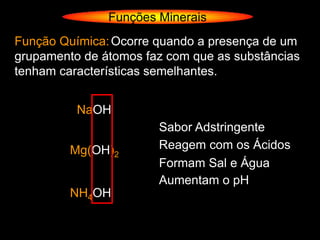
O documento descreve as principais teorias sobre ácidos e bases, incluindo as teorias de Arrhenius, Brønsted-Lowry e Lewis. Apresenta também a classificação de ácidos e bases quanto a propriedades como número de elementos, volatilidade, grau de ionização e solubilidade.

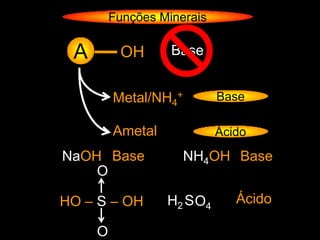
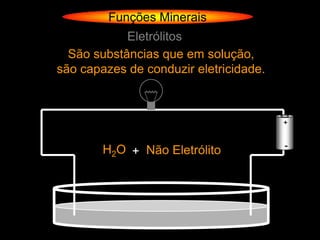
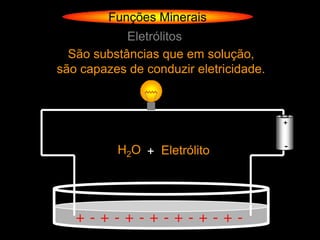
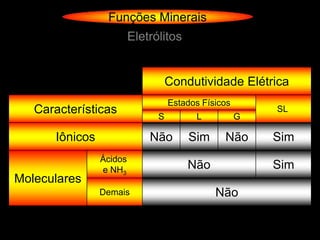






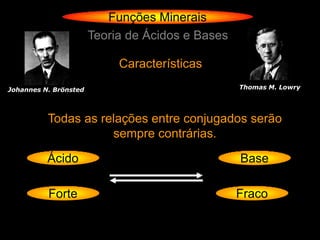


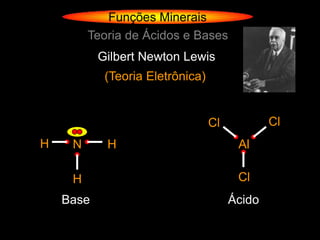
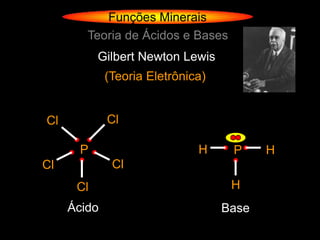
![Funções Minerais
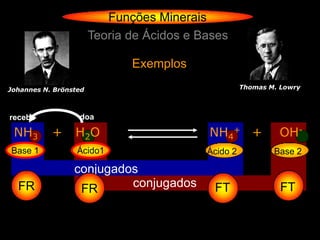
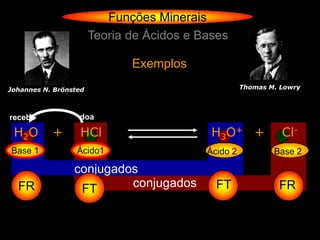
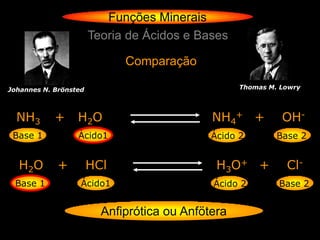
Teoria de Ácidos e Bases
Gilbert Newton Lewis
(Teoria Eletrônica)
Fe(CN)6-3 Base
NH4+ Ácido
S4O6-2 Base
[Pt(H2O)2 ]+4 Ácido](https://image.slidesharecdn.com/funesminerais-120507205304-phpapp02/85/Funcoes-Minerais-19-320.jpg)