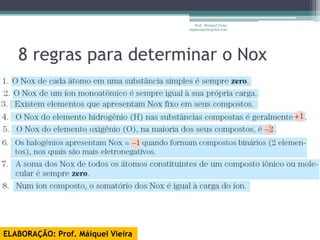
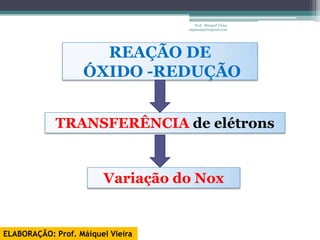
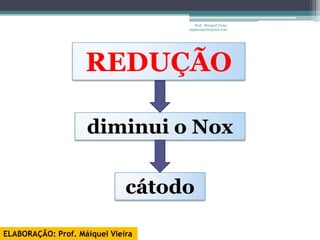
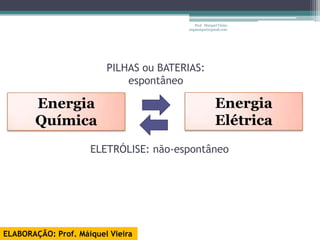
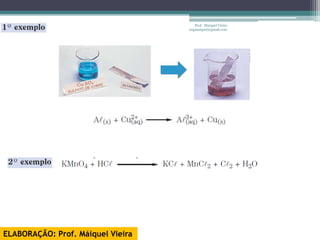
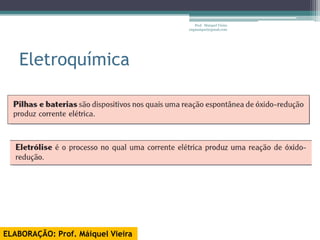
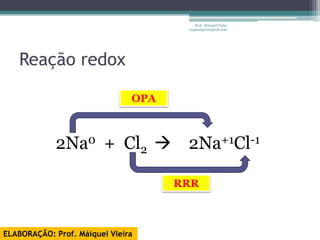
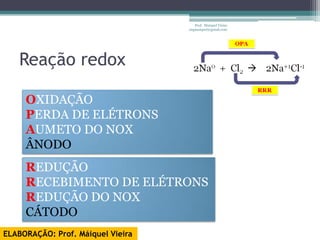
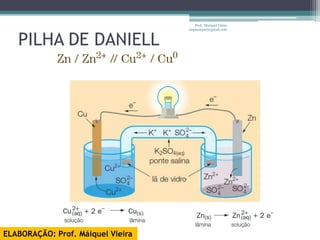
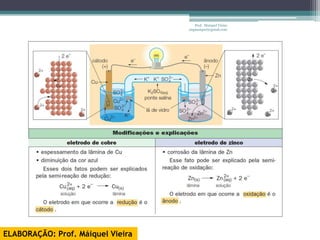
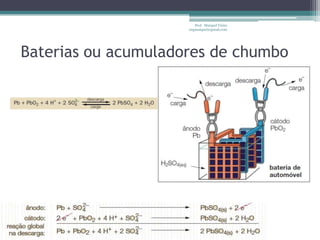
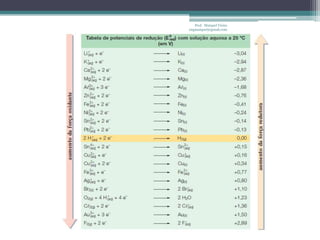
O documento discute reações de óxido-redução, incluindo exemplos como a fotossíntese e o metabolismo da glicose. Ele também explica o número de oxidação, regras para determiná-lo, e como as reações de óxido-redução envolvem transferência de elétrons e variação no número de oxidação.