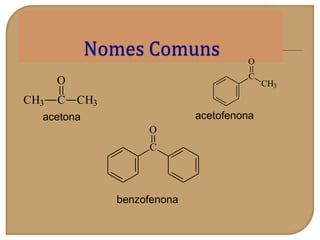
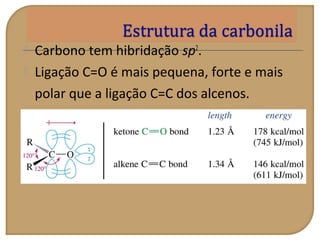
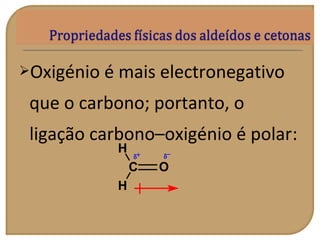
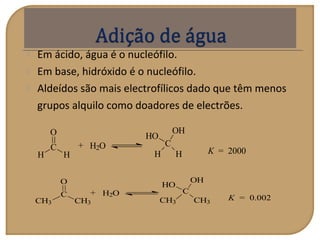
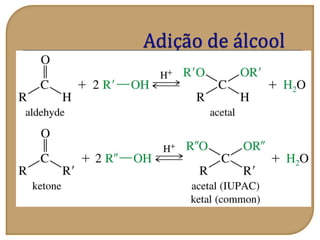
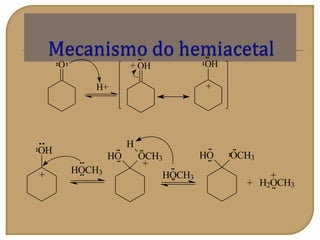
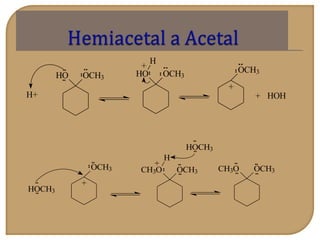
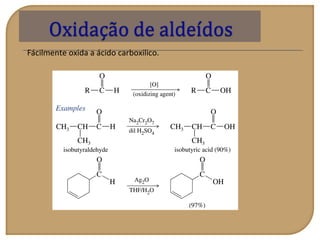
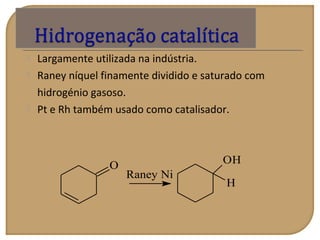
O documento discute as propriedades químicas de aldeídos e cetonas. Explica que aldeídos e cetonas contêm o grupo funcional carbonila (C=O) e são mais polares do que hidrocarbonetos devido à eletronegatividade do oxigênio. Também descreve várias reações químicas que aldeídos e cetonas podem participar, como oxidação, redução, adição nucleofílica e condensação.