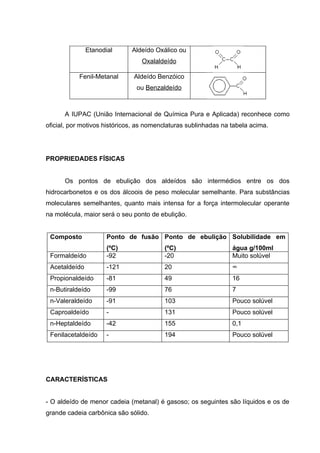
Os aldeídos são compostos orgânicos caracterizados pelo grupo funcional formila (H-C=O) ligado a uma cadeia alifática ou aromática. São obtidos pela oxidação de álcoois primários ou desidrogenação catalítica de álcoois na presença de cobre. São classificados de acordo com o número de grupos formila e a natureza dos radicais ligados. Apresentam propriedades físicas intermediárias entre hidrocarbonetos e álcoois de massa molecular similar.