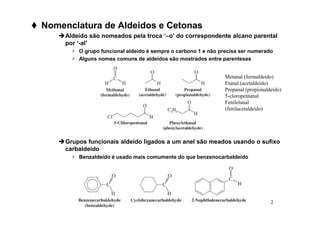
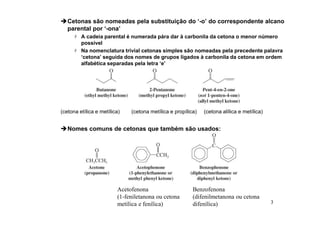
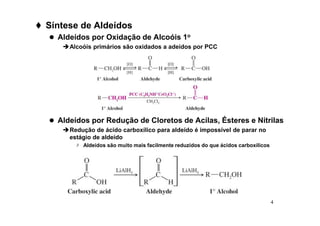
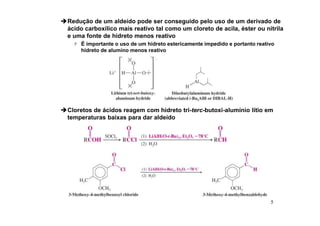
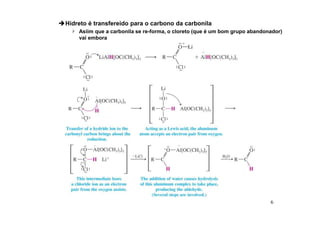
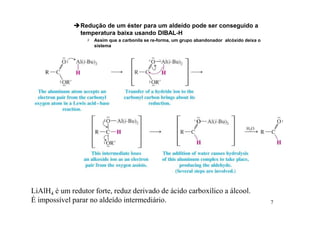
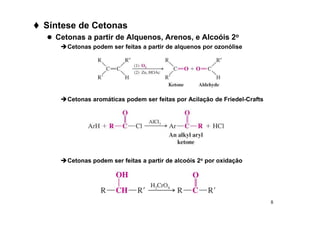
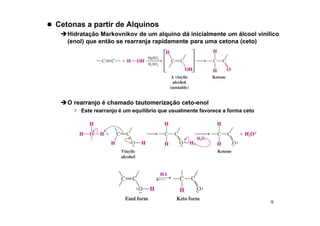
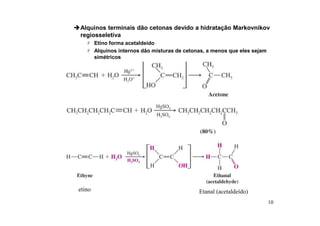
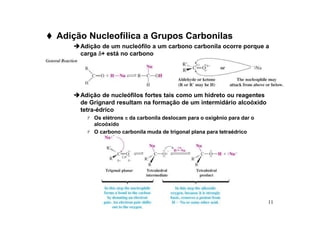
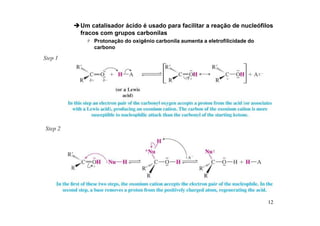
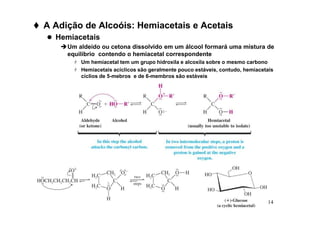
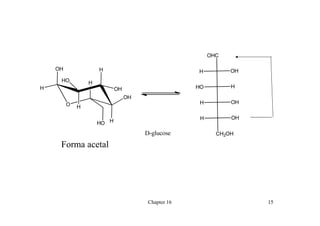
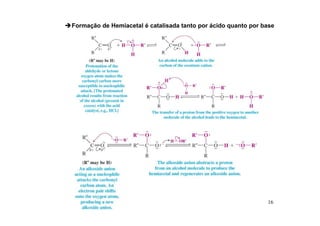
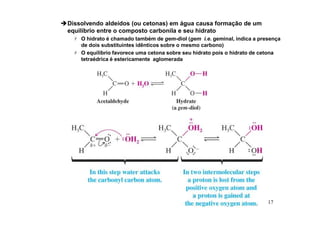
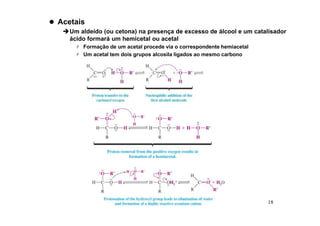
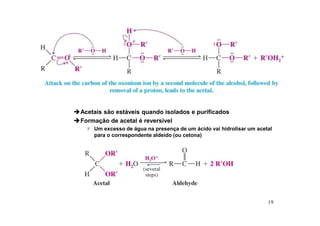
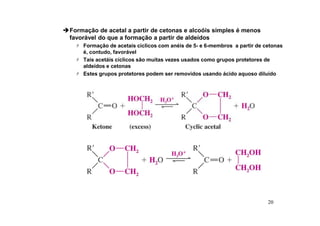
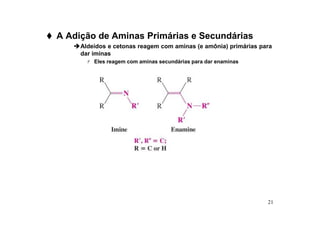
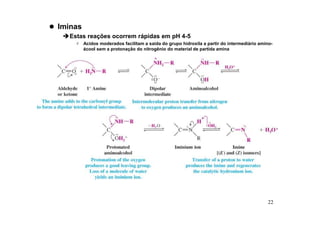
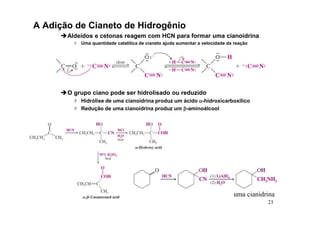
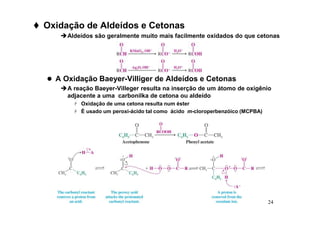
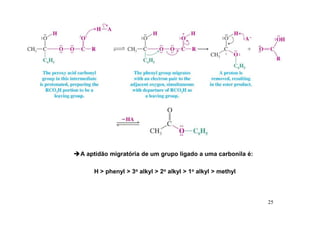
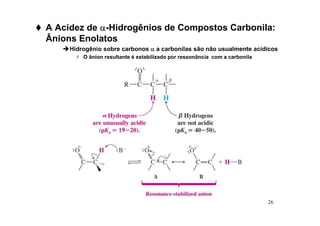
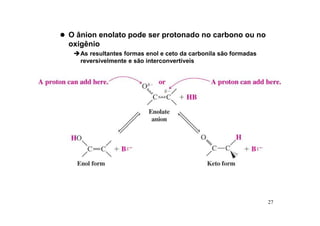
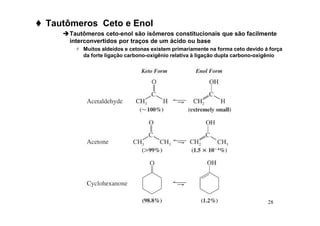
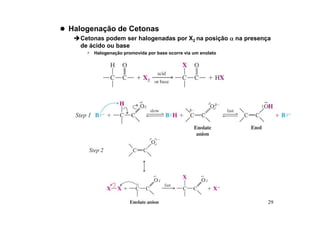
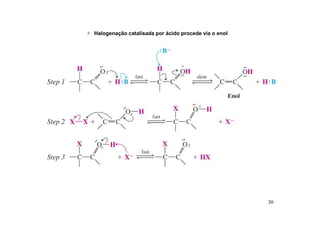
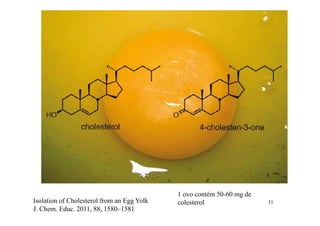
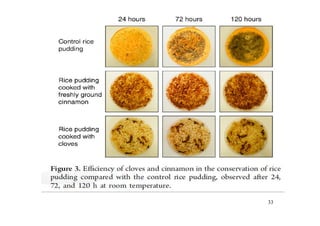
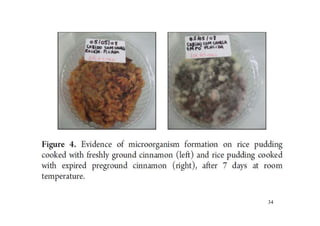
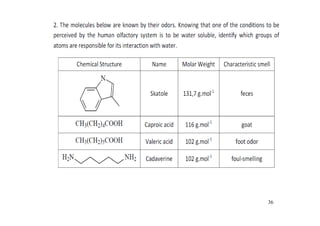
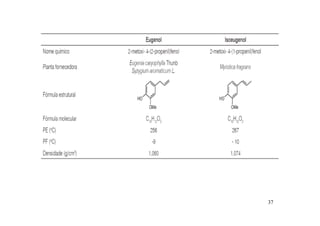
O documento discute aldeídos e cetonas, incluindo sua nomenclatura, síntese e reações. Apresenta métodos para sintetizar aldeídos e cetonas a partir de outros compostos orgânicos e descreve reações de adição nucleofílica aos grupos carbonila, como a formação de hemiacetais, acetáis, iminas e cianoidrinas.