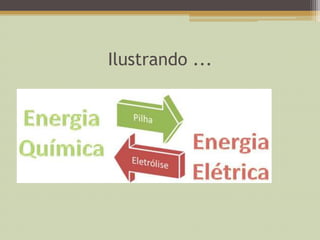
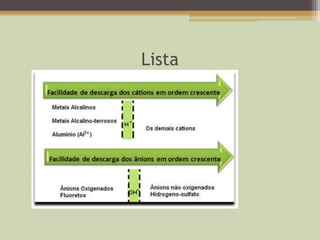
O documento descreve o processo de eletrolise, que converte energia elétrica em energia química ao contrário de uma pilha. Explica que a eletrolise é usada na indústria para isolar substâncias como alumínio e cloro. Detalha os dois tipos de eletrolise, ígnea em substâncias fundidas e aquosa em soluções, e como os íons participam nas reações nas superfícies dos eletrodos.