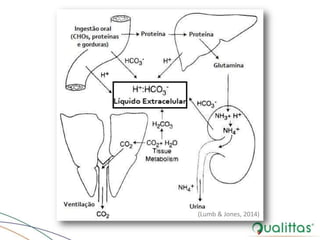
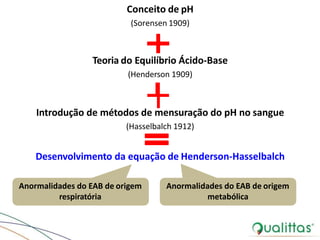
O documento discute abordagens para avaliação do equilíbrio ácido-base (EAB) na medicina veterinária, destacando a importância de metodologias diversas e a comparação entre as teorias de Henderson-Hasselbalch e Stewart. Também aborda mecanismos de regulação e compensação do EAB, além de implicações de distúrbios eletrolíticos e estratégias de fluidoterapia em pacientes com desequilíbrios. Conclui com a necessidade de personalizar o tratamento com base na condição clínica específica do paciente.


![AVALIAÇÃO DO EAB
-
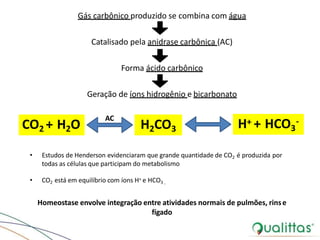
• 1ª abordagem:
– Abordagem tradicional
– Equação de Henderson-Hasselbach
– Avaliação de pH, pCO2 e HCO3
– Pode-se avaliar BE e ÂnionGap
• 2ª abordagem:
– Abordagem de Stewart – abordagem independente de variável
– Definição de EAB em 3 variáveis:
• pCO2, SID e ATOT
• 3ª abordagem:
– Conceito de Stewart com BE – semi-quantitativo
– Influência da contribuição individual do BE
– Alterações em água livre, cloreto, albumina, fósforo e [lactato]](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-3-320.jpg)


![CONCEITO DE pH
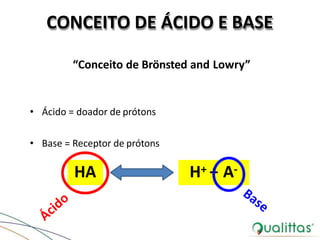
• Acidez de uma solução: atividade química de íons H+
• Depende de:
– Diretamente proporcional à temperatura
– Inversamente proporcional à força iônica da solução
• Concentração de íons H+ = nEq/L
“Conceito de Sorensen”
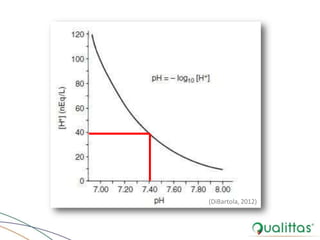
• pH: concentração de íons H+ em uma solução
pH = - log10 [H+] = log10 1
[H+]](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-9-320.jpg)

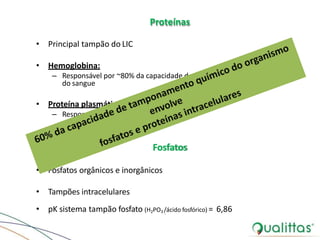
![• Principais tampões químicos:
Bicarbonato / ácido carbônico
Proteínas
Fosfatos
• Funcionalmente:
Aumento de [H+] no organismo
Ânion do tampão (HCO3
-, HPO4
- e Prot-) recebe excesso de prótons
Transforma em seu ácido conjugado
(H2CO3, H2PO4 e HProt)](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-13-320.jpg)

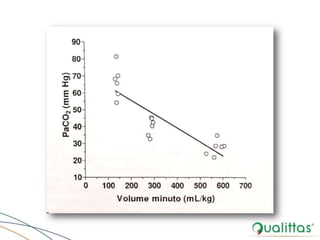
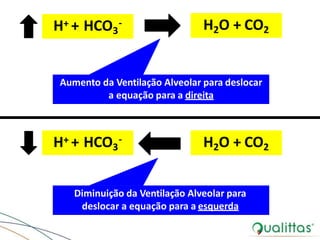
![Regulação Pulmonar do EAB
• Via alternativa
– [H+] controlada por variação da pCO2
– Atuam de forma integrada com o sistema tampão bicarbonato /
ácido carbônico na manutenção do EAB
• Localização de quimiorreceptores, principalmente, no bulbo
e corpo carotídeo
– Ajustam respiração de acordo com alterações na [H+]
• Relação inversa entre PCO2 e ventilaçãoalveolar
– Processo controlado por quimiorreceptores centrais (SNC) e
periféricos
– PCO2 mantida constante (35-45 mmHg) - ajuste na ventilação
alveolar](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-16-320.jpg)
![Regulação Renal do EAB
• Em situação fisiológica
• Rins mantém [HCO3 ] dentro dos valores normais no LEC-
• Ocorre ainda a excreção do excesso de H+ produzido
Reabsorção do HCO -
3
presente no filtrado
ultraglomerular
Regeneração do HCO -
3
consumido pelo processo
diário de produção de
ácidos fixos (H+)](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-19-320.jpg)





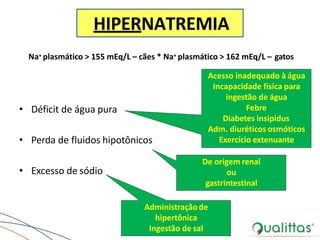
![Distúrbios do Sódio (Na+)
• Concentração plasmática de Na+ dentro dos limites
normais
– Mecanismos homeostáticos eficientes
– Ativados mesmo em condições de depleção
• Volume do LEC
– Diretamente dependente do conteúdo de Na+ corpóreo
total
• Balanço hídrico
– [Na+] e osmolalidade plasmática](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-27-320.jpg)
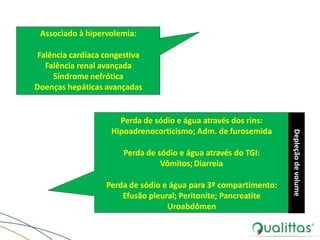
![• Na+: responsável por 95% da osmolalidade
plasmática
– ↑ [Na+] -> ↑ Osmolalidade plasmática
• Desidratação celular
• Sinais clínicos:
– [Na+] próxima ou superior a 170 mEq/L
– Disfunção neurológica
– Pode progredir para coma e morte](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-29-320.jpg)

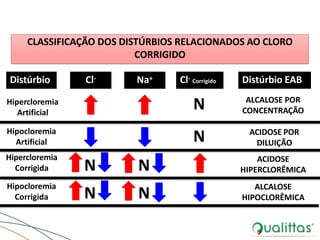
![Distúrbios do Cloreto (Cl-)
• Ânion encontrado em maior quantidade no LEC
• Mudanças nos níveis plasmáticos influenciam diretamente o
EAB
– ↑ cloreto = acidose metabólica hiperclorêmica
– ↓ cloreto = alcalose metabólica hipoclorêmica
• Correção da [Cl-] -> interpretação correta
– Baseada na [Na+]
Na+
x 146
(mens)
Cl-
(corrigido) = Cl-
(mens) Cl-
(corrigido) = Cl-
(mens)
Na+
x 156
(mens)Cães Gatos](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-32-320.jpg)


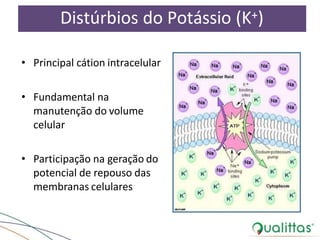

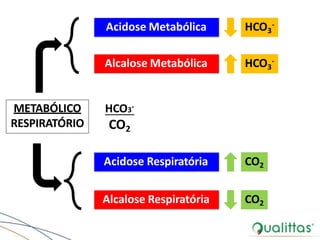
![Regulação do Potássio (Transferência)
Acidose Metabólica
[K+]
[H+]
[K+]
[H+]
[K+]
[H+]
[H+]
[AHum+]entoda
[K+] sérica
Alcalose Metabólica
[K+]
[H+]
Diminuição da
[K+] sérica
[H+]](https://image.slidesharecdn.com/eabefluidoterapia-170718115719/85/Eab-e-fluidoterapia-38-320.jpg)