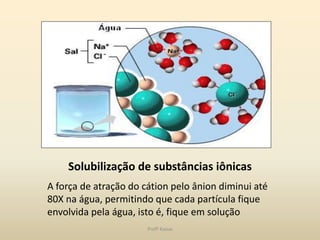
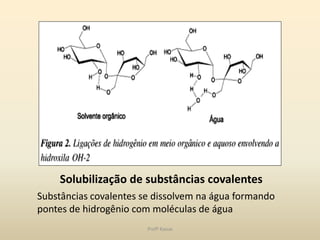
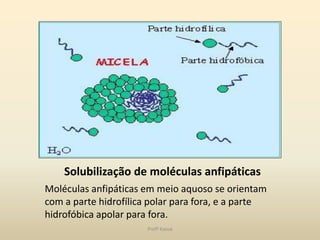
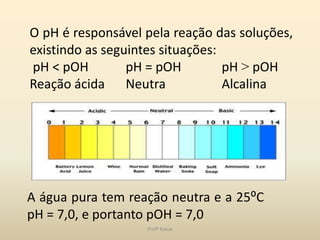
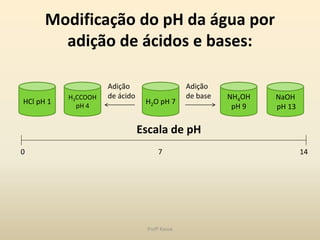
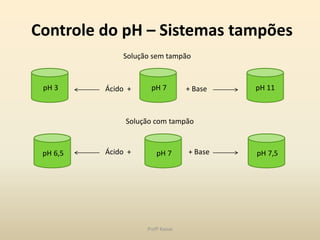
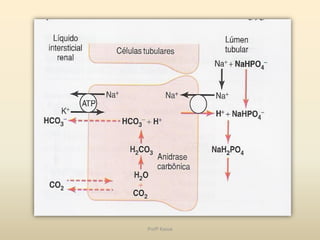
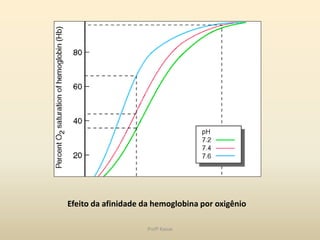
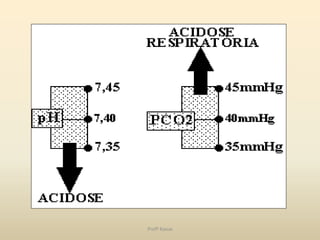
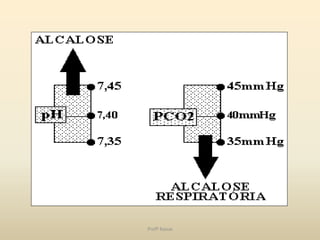
O documento discute a água e tampões no contexto da bioquímica estrutural. A água é capaz de solubilizar substâncias iônicas, covalentes e anfipáticas através da formação de pontes de hidrogênio. O pH é controlado por sistemas tampão que mantêm o equilíbrio ácido-base, como o sistema bicarbonato/ácido carbônico no organismo. Distúrbios no equilíbrio ácido-base incluem acidose e alcalose respiratória e metabólica.