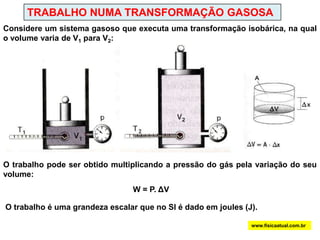
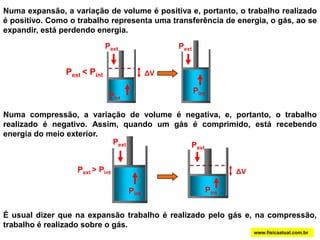
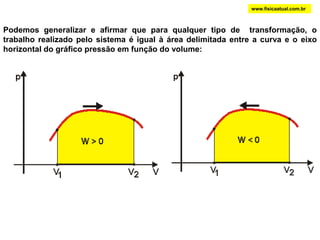
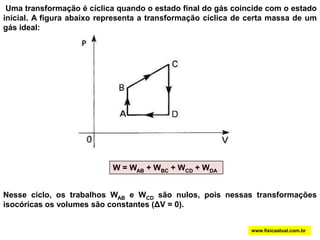
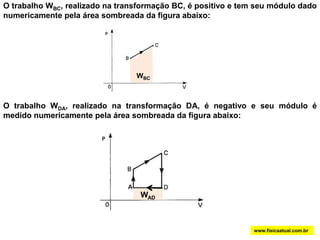
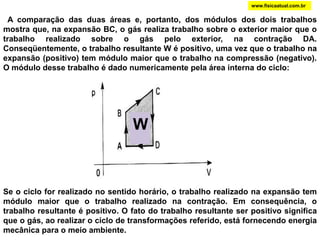
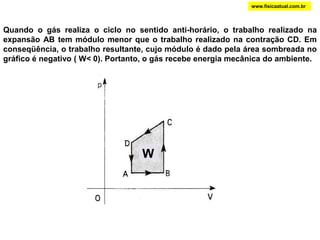
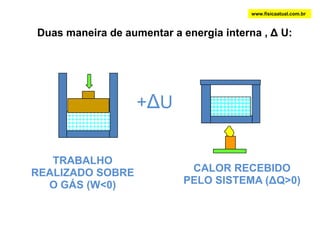
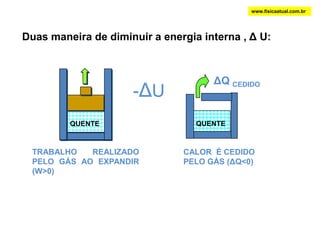
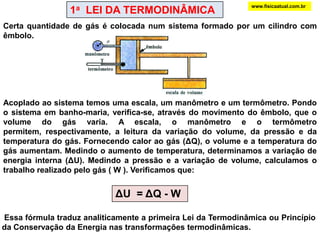
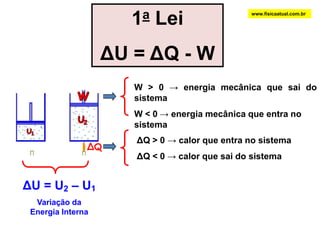
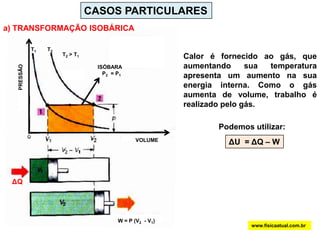
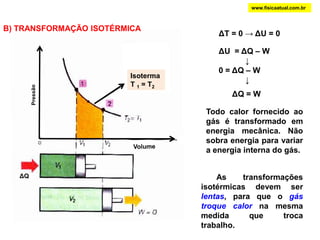
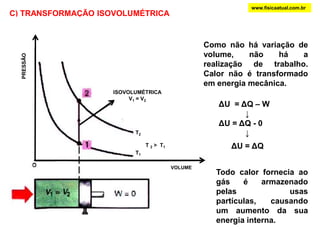
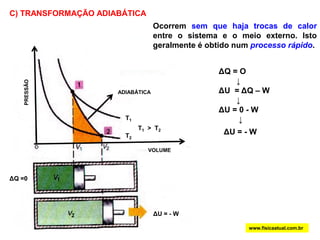
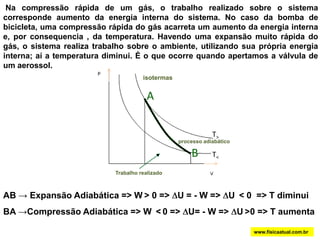
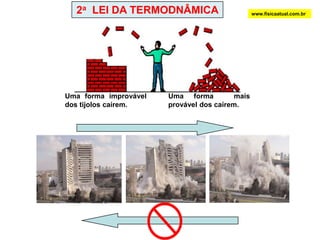
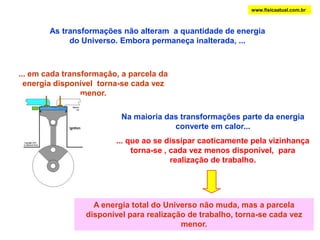
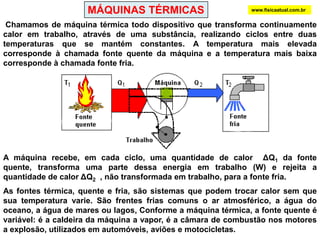
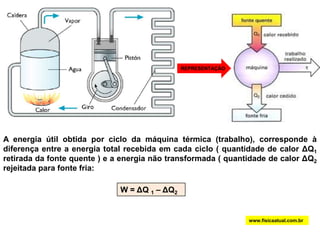
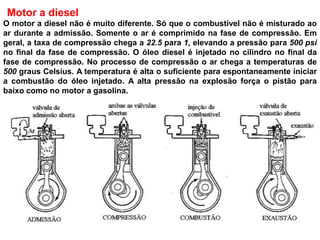
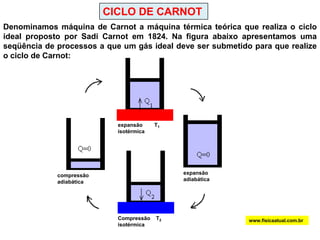
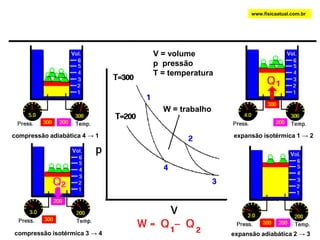
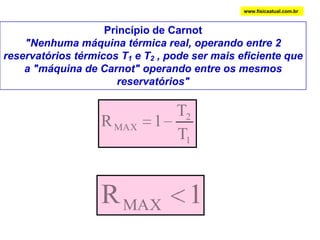
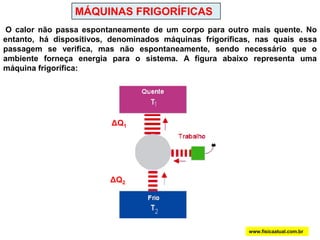
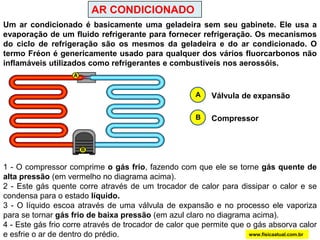
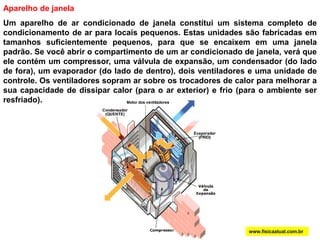
O documento discute a termodinâmica e as leis da termodinâmica. A primeira lei afirma a conservação de energia, enquanto a segunda lei diz que a parcela de energia disponível para trabalho torna-se menor a cada transformação, à medida que parte da energia se converte em calor dissipado. Máquinas térmicas podem transformar calor em trabalho, porém nunca de forma integral devido à segunda lei.