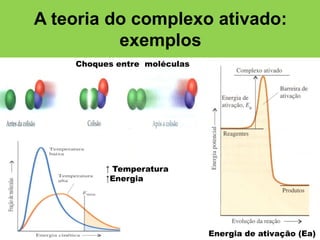
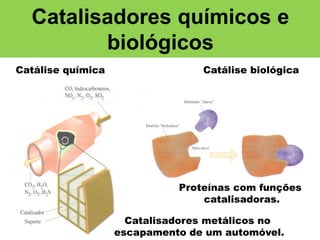
O documento aborda a cinética química, explicando seus conceitos fundamentais, como a velocidade de reações, leis de velocidade e a teoria do complexo ativado. Exemplos ilustram a aplicação das leis de velocidade integrada de primeira e segunda ordem, além do papel dos catalisadores em reações químicas. A revisão inclui a definição de cinética química e as características das reações e catalisadores.




![Velocidade de uma reação
química e unidade
Na física:
Vm=∆S/∆t .: ∆S= variação da posição e
∆t= variação do tempo.
Na química:
Vm=-∆[x]/∆t .: x massa do composto
molaridade do composto e ∆t= variação do
tempo.](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-5-320.jpg)
![Velocidade de uma reação química e
Velocidade de uma reação
a concentração
química e a concentração
• Vm=-∆[x]/∆T
Vm=-∆[x]/∆t
aA + bB cC + dD
Reação química genérica
aA + bB cC + dD
Reação química genérica
• Como expressar a velocidade de uma reação
Como independentemente de
química expressar a velocidade dos uma reação
coeficientes
química independentemente dos coeficientes
estequimiométrico?
estequimiométrico?
vm = 𝑉𝑚
1∆[𝐴]
=𝑎∆𝑇
1∆[𝐵]
𝑏∆𝑇
=
1∆[𝐶] 1∆[𝐷]
𝑐∆𝑇
=
𝑑∆𝑇](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-6-320.jpg)
![A velocidade instantânea
velocidade instantânea da reação
de uma reação
Vm = Vm
1d[A]
a∆T
=-
1d[B]
b∆T
=
1d[C]
c∆T
=
1d[D]
d∆T
Velocidade de uma reação química em
termos da derivada*.
* Derivada: Operação matemática relacionando
duas variáveis.](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-7-320.jpg)
![Lei de velocidade
V=
a
k[X]
.: V=V(X)
V velocidade da reação; k Constante de
velocidade e X Concentração da espécie.
Expresse a velocidade de isomerização do isocianeto de
hidrogênio para cianeto de hidrogênio?
1) Reação química:
HNC(g) HCN(g)
2) Lei de velocidade*:
V=k[HNC]a
*Uma lei de velocidade é determinada experimentalmente.](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-8-320.jpg)
![Lei de velocidade e ordem
de uma reação
Ordem da reação*: valor do expoente da
concentração
Exemplo: H2 + Br2 2HBr .: V= k[H2][Br2]1/2
Ordem de reação para [H2] = 1
Ordem de reação para [Br2] = ½
Qual a ordem de reação global para a
reação acima? 1+1/2 = 3/2.
*A ordem da reação assuem valores inteiros ou semi-inteiros.](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-9-320.jpg)

![Lei de velocidade integrada de
primeira ordem
V=k[A] V = - d[A]/dt = k[A]
d[A]/[A]=-kdt
[A]f=[A]oe-kt](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-11-320.jpg)
![Aplicação da Lei de velocidade
integrada de primeira ordem
Calcule a concentração de N2O5 remanescente 600s
(10min) após o início de sua decomposição a 65ºC,
quando sua concentração inicial era 0,040 Mol/L. A
constante k vale 5,2x10-3 s-1.
1) reação química: 2N2O5(g) 4NO2(g) + O2(g)
2) velocidade: V=k[N2O5]
3) [A]f=[A]oe-Kt: [N2O5]f= [N2O5]ie-kt
4) [N2O5]f= (0,040 Mol/L).e-(5,2x10-3s-1)x(600s)
5) [N2O5]f= 0,0018Mol/L
Análise da reação:
Após 600s, a concentração de N2O5 cai de 0,040 Mol/L
para 0,0018 Mol/L.](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-12-320.jpg)
![Lei de velocidade integrada de
segunda ordem
• V=k[A] 2 V =-d[A]/dt = k[A]2
d[A]/[A]2=-kdt
[A]f=
[A]o
1 + [A]okt](https://image.slidesharecdn.com/conceitosbsicosdecinticaqumica-140215074303-phpapp01/85/Conceitos-de-cinetica-quimica-13-320.jpg)