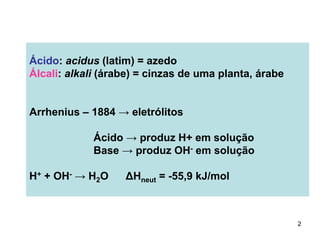
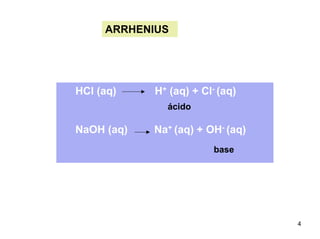
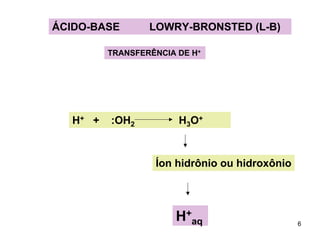
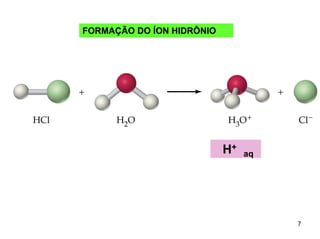
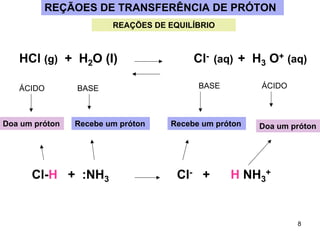
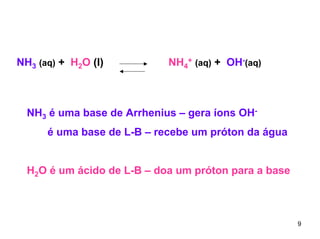
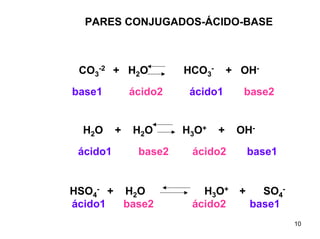
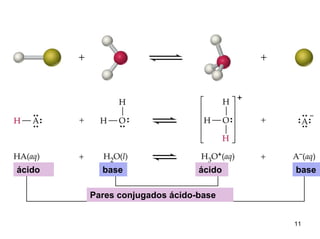
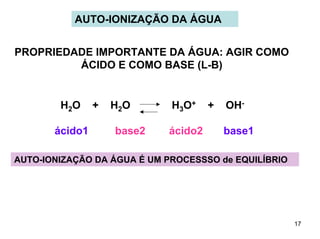
1) Ácidos e bases podem ser definidos segundo as teorias de Arrhenius e Lowry-Bronsted. Arrhenius define ácidos como substâncias que produzem íons H+ em solução e bases como substâncias que produzem íons OH-. Lowry-Bronsted define ácidos e bases como substâncias capazes de doar ou receber prótons.
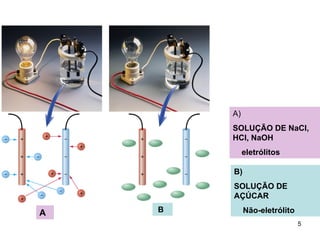
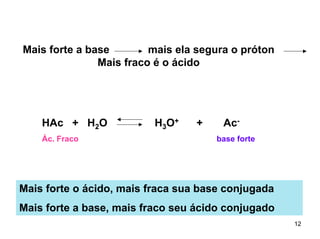
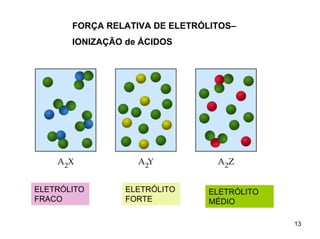
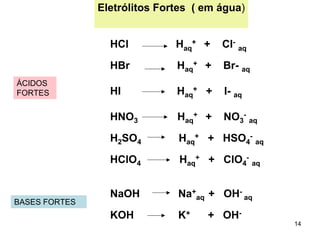
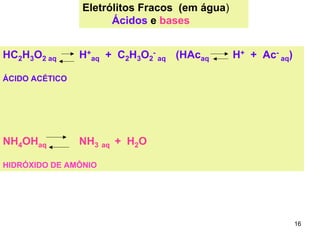
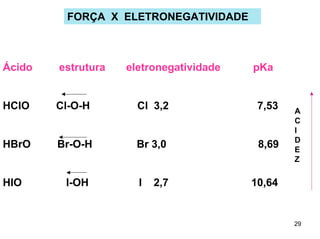
2) Ácidos e bases fortes ionizam completamente em solução aquosa, enquanto ácidos e bases fracas estabelecem equilíbrios químicos. A for



![K eq = [H3O+ ] [OH-]
Kw
(w – water)
Constante de equilíbrio da água =
constante do produto iônico
18](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-18-320.jpg)
![K w = [H3O+ ] [OH-] = 1,0 x 10-14 ( a 250C)
ACIDEZ e BASICIDADE dependem
basicamente do numero relativo de
íons H+ e OH- presentes em solução.
19](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-19-320.jpg)
![EM SOLUÇÕES NEUTRAS A CONCENTRAÇÃO DE
[ H+ ] = [ OH- ]
EM SOLUÇÕES ÁCIDAS A CONCENTRAÇÃO DE
[ H+ ] > [ OH- ]
EM SOLUÇÕES BÁSICAS A CONCENTRAÇÃO DE
[ OH- ] > [ H+ ]
20](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-20-320.jpg)
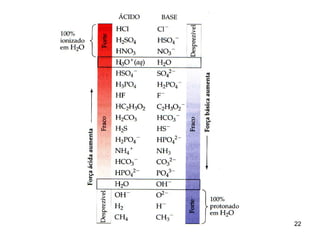
![A ESCALA DE pH
Como as soluções que empregamos comumente são
diluídas, sua concentração de íons de H+ é muito baixa.
Portanto, é mais adequado expressar a [H+] em
potências negativas de 10.
pH = - log [H+]
[H3O+] = [OH-] = 10-7 M
H2O pura
pH = pOH = 7
21](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-21-320.jpg)
![HCl 0,1 M → H+ ou H3O+ = 0,1M = 1x10-1
(H+ da auto-ionização da H2O é desprezível < que 10-7M
[ OH- ] =
10 -14
10 −14
= −1 = 10 −13 M
+
[ H 3O ] 10
(muito pequena)
pH = pKw – pOH = 14 – 13
pH = 1 solução ácida
23](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-23-320.jpg)
![Solução de NaOH 0,01M
[ H3O+] =
−14
Kw
10
−12
= −2 = 10 M
−
[OH ] 10
Muito pequena
pH = 12 solução básica
24](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-24-320.jpg)
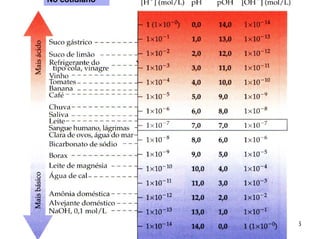
![Solução Ácida [H+] > [OH-]; [H+] > 10-7M
pH < 7
Solução Básica [OH-] > [H+]; [OH-] < 10-7M
pH > 7
Solução Neutra [H+] = [OH-] = 10-7 M
pH = 7
25](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-25-320.jpg)
![EQUILÍBRIO - ÁCIDOS FRACOS
HA + H2O
H3O+ + A-
Ka = [H3O+][ A-]
MEDIDA DA
[HA]
FORÇA ÁCIDA
Ka HAc = 1,85 x 10-5
pKa = 4,75
Ka HCN = 4,8 x 10-10
pKa = 9,3
Ka HF = 6,8 x 10-4
pKa = 3,2
27](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-27-320.jpg)
![EQUILIBRIO - BASES FRACAS
NH3 (aq) + H2O (l)
Kb =
pKb =
[ NH4+ ] [OH-]
[ NH3]
NH4+ (aq) + OH- (aq)
= 1,85 X 10 -5
4,75
28](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-28-320.jpg)

![EQUILÍBRIO ÁCIDO-BASE
HBaq
H+(aq) + B-(aq)
onde [H+] = [B-] e [HB] = conc inicial HB – [H+]
+
−
[ H ][ B ]
Ka =
[ HB]
31](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-31-320.jpg)
![EXEMPLO: Ácido nicotínico C6H5O2N (Ka = 1,4 x 10-5)
determine a concentração de H+ em uma solução
preparada dissolvendo-se 0,10M de HNic, para formar 1
litro de solução e a % de dissociação do ácido
HNic ↔ H+(aq) + Nic-(aq)
0,10 – x
x
x
[ HNic ] = 0,10 – x ≈ 0,10
Ka = [ x2 ] / [HNic ]
então:
x2 = 1,4 x 10-1 → x = 1,2 x 10-3 M = [H+]
+
% dissociação =
H
×100 = 1,2%
HNic
32](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-32-320.jpg)
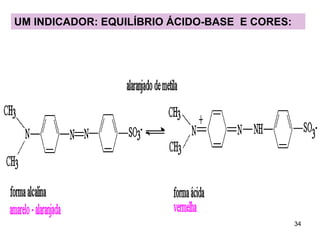
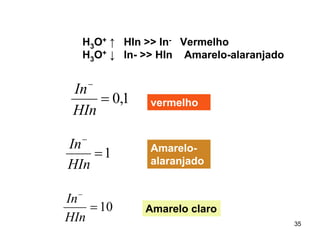
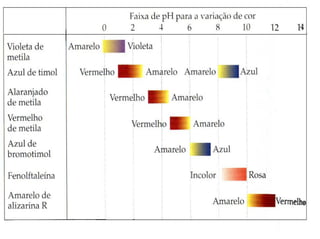
![INDICADORES – ÁCIDOS FRACOS
Moléculas de corantes → coloração depende da
concentração de [H3O+] ou [H+]aq da solução
HIn + H2O
H3O+ + In-
[ H 3O + ][ In − ]
KI =
[ HIn]
KI
[ In − ]
=
−
[ HIn ] [ H 3O + ]
33](https://image.slidesharecdn.com/aula8acidos-131212161742-phpapp02/85/Aula8acidos-33-320.jpg)