O documento discute os principais conceitos de equilíbrio químico, incluindo: (1) equilíbrio iônico em solução aquosa, com exemplos de solubilidade de sais e efeito do íon comum; (2) equilíbrio ácido-base, cobrindo as definições de ácidos e bases e a constante de autoionização da água; (3) precipitação seletiva dependendo das constantes de solubilidade.



![Sais pouco solúveis
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
𝐴𝑔+ 𝐶𝑙−
𝐾=
[𝐴𝑔𝐶𝑙(𝑠)]
𝐾 𝑝𝑠 = 𝐴𝑔+
𝐶𝑙−
PRODUTO DE
SOLUBILIDADE](https://image.slidesharecdn.com/equilbrioparte2-131015115924-phpapp01/85/Equilibrio-parte2-5-320.jpg)
![Sais pouco solúveis
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
𝐴𝑔+
𝐶𝑙− = 𝐾 𝑝𝑠 = 1,8 𝑥 10−10
𝐴𝑔+
Qual a
solubilidade
do AgCl em
água?
𝐶𝑙− = [𝐴𝑔+ ]2 = 1,8 𝑥 10−10
[𝐴𝑔+ ] = 1,3 𝑥 10−5 𝑀
𝑆𝑜𝑙𝑢𝑏𝑖𝑙𝑖𝑑𝑎𝑑𝑒 𝑑𝑜 𝐴𝑔𝐶𝑙 = 1,3 𝑥 10−5 𝑀](https://image.slidesharecdn.com/equilbrioparte2-131015115924-phpapp01/85/Equilibrio-parte2-6-320.jpg)















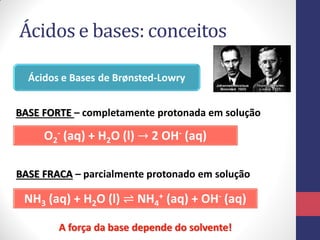
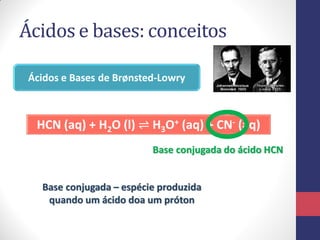
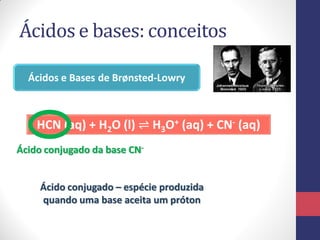






![A Escala de pH
pH = -log [H3O+]
pOH = -log [OH-]
Para a água pura, a molaridade dos íons H3O+ é
𝟏, 𝟎 𝒙 𝟏𝟎−𝟕 𝒎𝒐𝒍 𝑳−𝟏 , em 25°C. Seu pH será:
pH = -log [H3O+] = -log (1,0 x 10-7) = 7,0
• O pH da água pura é 7
• O pH de uma solução ácida é menor do que 7
• O pH de uma solução básica é maior do que 7](https://image.slidesharecdn.com/equilbrioparte2-131015115924-phpapp01/85/Equilibrio-parte2-32-320.jpg)

![A auto-ionização da água
CONSTANTE DO PRODUTO IÔNICO DA ÁGUA2 H2O ⇌ H3O+ + OHSolução neutra a 25°C:
[H3O+] = [OH-] = 1,00 x 10-7 M
pH = pOH = 7,00
pH + pOH = pKw = 14,00
Kw](https://image.slidesharecdn.com/equilbrioparte2-131015115924-phpapp01/85/Equilibrio-parte2-34-320.jpg)









![Equação de HendersonHasselbalch
[𝑏á𝑠𝑖𝑐𝑜] 𝑖𝑛𝑖𝑐𝑖𝑎𝑙
𝑝𝐻 = 𝑝𝐾 𝑎 + 𝑙𝑜𝑔
[á𝑐𝑖𝑑𝑜] 𝑖𝑛𝑖𝑐𝑖𝑎𝑙](https://image.slidesharecdn.com/equilbrioparte2-131015115924-phpapp01/85/Equilibrio-parte2-44-320.jpg)

![Exemplos
SOLUÇÃO TAMPÃO
4) Supõe-se que um tampão NH4+-NH3 seja capaz de manter o
pH de uma solução constante, dentro da faixa de 0,30 unidades
de pH, durante a reação:
CH3COOCH3 + 2H2O → CH3COO- + H3O+ + CH3OH
Se a solução tampão tivesse a seguinte composição inicial,
[CH3COOCH3]0 = 0,020 M
[NH4+]0 = 0,100 M
[NH3]0 = 0,058 M
quais seriam os pH’s inicial e final da solução? Este tampão
satisfaz as condições acima descritas?](https://image.slidesharecdn.com/equilbrioparte2-131015115924-phpapp01/85/Equilibrio-parte2-46-320.jpg)

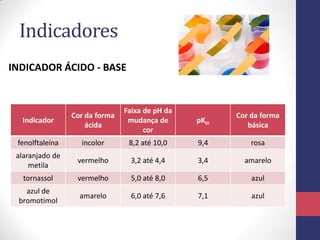
![Indicadores
INDICADOR ÁCIDO - BASE
HIn (aq) + H2O (l) ⇌ H3O+ (aq) + In- (aq)
𝐾 𝐼𝑛 =
𝐻3 𝑂+ 𝐼𝑛 −
𝐻𝐼𝑛
• Ponto final de uma titulação: [HIn] = [In-]
• Mudança de cor: pH = pKIn
• A cor começa a mudar perceptivelmente em torno de uma
unidade de pH antes do pKIn e está efetivamente completa
em torno de 1 unidade de pH após o pKIn.](https://image.slidesharecdn.com/equilbrioparte2-131015115924-phpapp01/85/Equilibrio-parte2-48-320.jpg)