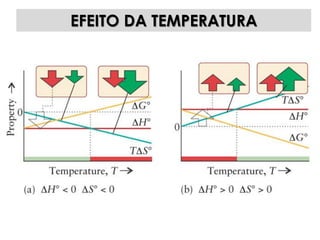
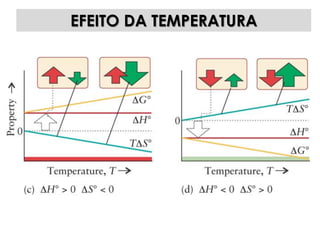
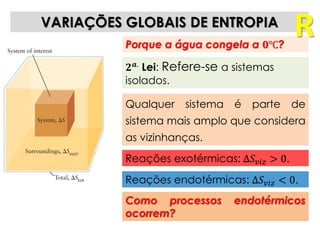
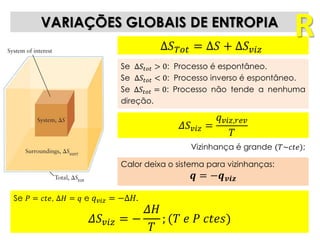
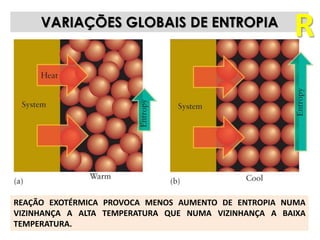
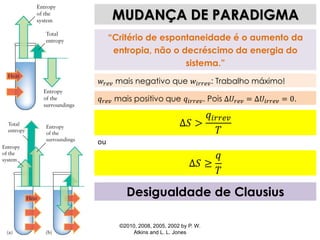
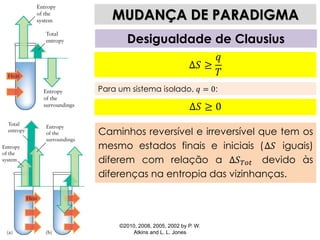
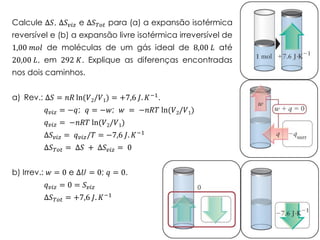
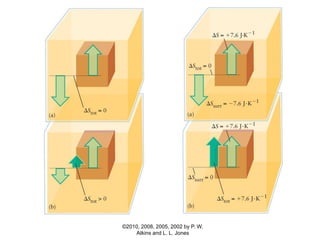
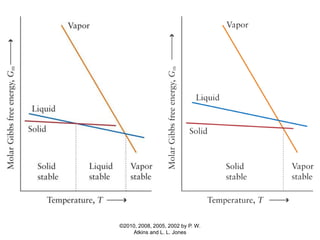
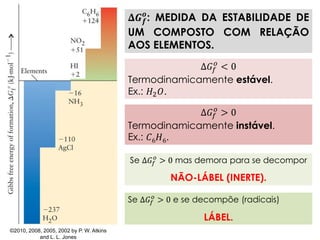
1) O documento discute os conceitos de variação de entropia, variação de entropia da vizinhança e variação de entropia total para determinar a espontaneidade de processos termodinâmicos.
2) É explicado que processos endotérmicos podem ocorrer se a variação de entropia total for positiva, levando em conta a entropia cedida à vizinhança.
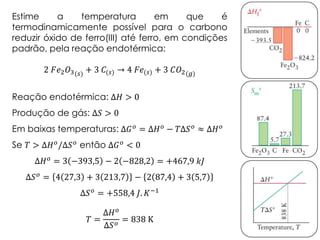
3) São apresentados exemplos numéricos de cálculo de variações de entropia para diferentes processos físicos e químicos

![©2010, 2008, 2005, 2002 by P. W.
Atkins and L. L. Jones
Calcule a variação de entropia da
vizinhança quando a água congela em
− 10℃ . Use Δ𝐻𝑓𝑢𝑠 𝐻2 𝑂 = 6,0 𝑘𝐽. 𝑚𝑜𝑙−1 em
− 10℃.
Δ𝐻 𝑐𝑜𝑛𝑔 = − Δ𝐻 𝑓𝑢𝑠
Δ𝑆 𝑉𝐼𝑍 = − Δ𝐻/𝑇 = +23 𝐽 · 𝐾
− 1 · 𝑚𝑜𝑙
− 1
Calcule a variação de entropia da
vizinhança quando 1,00 mol de H2O(l)
vaporiza em 90oC e 1 bar. Considere a
entalpia de vaporização da água como
40,7 kJ·mol-1.
[Resposta: -112 J·K-1]
Calcule a variação de entropia da
vizinhança quando 2,00 mols de NH3(g) se
formam a partir dos elementos em 298 K
R](https://image.slidesharecdn.com/controlenotasdivulgacao-160202200321/85/Quimica-Geral-2016-1-Aula-16-5-320.jpg)






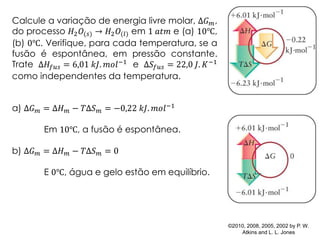
![Calcule a variação de energia livre de Gibbs molar do processo
𝐻2 𝑂(𝑙) → 𝐻2 𝑂(𝑔) em 1 𝑎𝑡𝑚 e (a) 95℃, (b) 105℃. A entalpia de
vaporização (Δ𝐻𝑣𝑎𝑝) é 40,7 𝑘𝐽. 𝑚𝑜𝑙−1 e a entropia de vaporização
( Δ𝑆 𝑣𝑎𝑝 ) é +109,1 𝐽. 𝐾−1
. 𝑚𝑜𝑙−1
. Indique, em cada caso, se a
vaporização é espontânea ou não.
[Resp.: (a) Δ𝐺 𝑚 = +0,6 𝑘𝐽. 𝑚𝑜𝑙−1 , não espontânea; (b) Δ𝐺 𝑚 =
− 0,5 𝑘𝐽. 𝑚𝑜𝑙−1, espontânea]
Calcule a variação de energia livre de Gibbs molar do processo
𝐻𝑔(𝑙) → 𝐻𝑔(𝑔) em 1 𝑎𝑡𝑚 e (a) 350℃, (b) 370℃. A entalpia de
vaporização (Δ𝐻𝑣𝑎𝑝) é 59,3 𝑘𝐽. 𝑚𝑜𝑙−1
e a entropia de vaporização
( Δ𝑆 𝑣𝑎𝑝 ) é 94,2 𝐽. 𝐾−1. 𝑚𝑜𝑙−1 . Indique, em cada caso, se a
vaporização é espontânea ou não.](https://image.slidesharecdn.com/controlenotasdivulgacao-160202200321/85/Quimica-Geral-2016-1-Aula-16-18-320.jpg)



![Calcule a energia livre padrão de formação de 𝑁𝐻3(𝑔) em 25℃,
usando a entalpia de formação e as entropias molares das
espécies envolvidas em sua formação.
[Resposta: −16,6 𝑘𝐽. 𝑚𝑜𝑙−1]
Calcule a energia livre padrão de formação do 𝐶3 𝐻6(𝑔)
, ciclo
propano, em 25℃.](https://image.slidesharecdn.com/controlenotasdivulgacao-160202200321/85/Quimica-Geral-2016-1-Aula-16-23-320.jpg)
![Calcule a energia livre de Gibbs padrão da reação
4𝑁𝐻3(𝑔) + 5𝑂2(𝑔) ⟶ 4𝑁𝑂 𝑔 + 6𝐻2 𝑂(𝑔)
e decida se a reação é espontânea em condições
padrão em 25℃.
Calcule a energia livre de Gibbs padrão da reação
2𝐶𝑂(𝑔) + 𝑂2(𝑔) ⟶ 2𝐶𝑂2 𝑔
e decida se a reação é espontânea em condições
padrão em 25℃.
[Resp.: ΔGo = −514,38 kJ]
Calcule a energia livre de Gibbs padrão da reação
6𝐶𝑂2(𝑔) + 6𝐻2 𝑂(𝑙) ⟶ 𝐶6 𝐻12 𝑂6 𝑠,𝑔𝑙𝑖𝑐𝑜𝑠𝑒
+ 6𝑂2(𝑔)
e decida se a reação é espontânea em condições
padrão em 25℃.](https://image.slidesharecdn.com/controlenotasdivulgacao-160202200321/85/Quimica-Geral-2016-1-Aula-16-25-320.jpg)