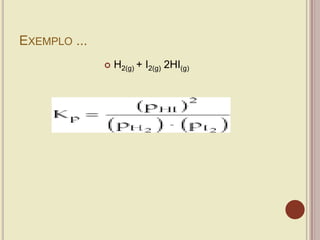O documento discute os principais tópicos sobre equilíbrio químico, incluindo conceito, classificação, grau de equilíbrio, constantes de equilíbrio Kc e Kp, relação entre Kc e Kp, deslocamento de equilíbrio, equilíbrio iônico e a lei da diluição de Ostwald.










![4-CONSTANTE DE EQUILÍBRIO EM TERMOS DAS
CONCENTRAÇÕES MOLARES (KC)
Dada uma reação reversível qualquer:
aA + bB cC + dD
Aplicando-se a lei da ação das massas de
Guldberg-Waage, temos:
• para a reação direta:
v1 = K1 · [A]a · [B]b
• para a reação inversa:
v2 = K2 · [C]c · [D]d
No equilíbrio: v1 = v2
K1 · [A]a · [B]b = K2 · [C]c · [D]d](https://image.slidesharecdn.com/aula2-equilbrioqumico-130704085031-phpapp01/85/Aula-2-equilibrio-quimico-11-320.jpg)