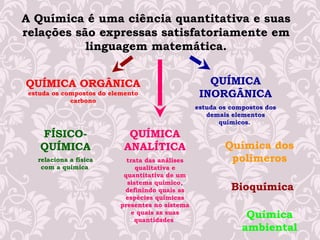
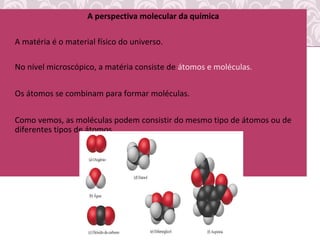
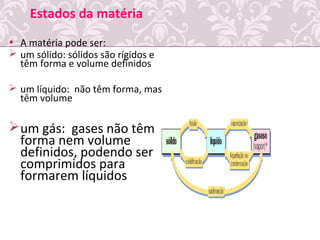
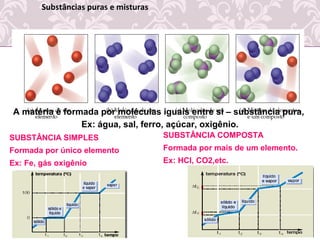
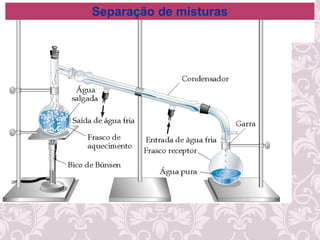
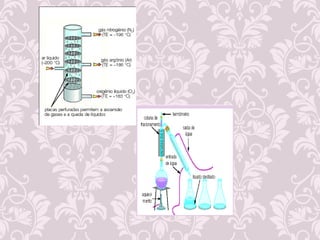
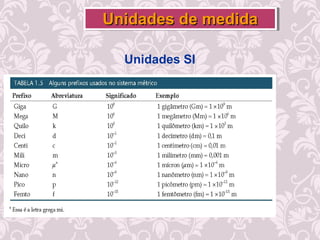
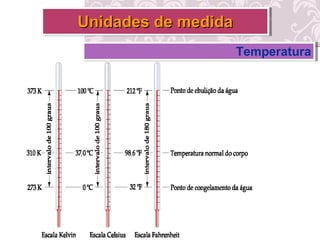
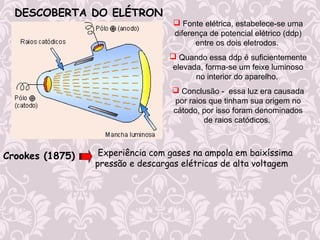
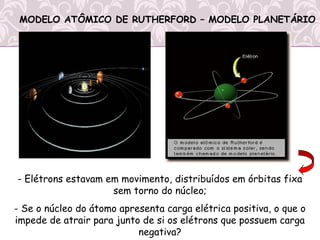
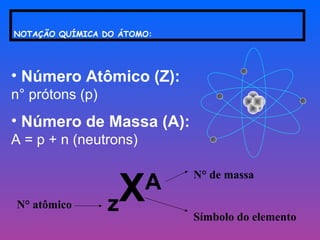
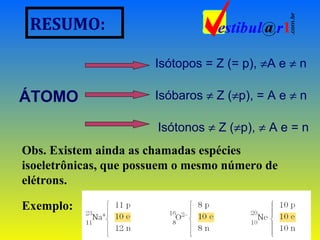
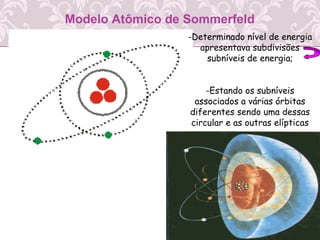
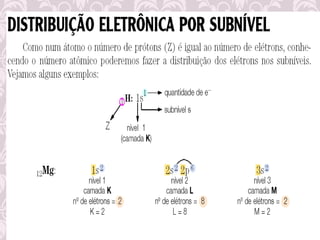
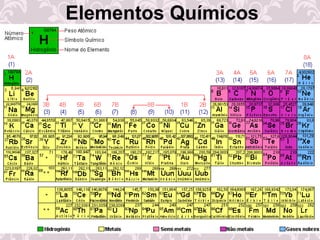
O documento fornece uma revisão sobre química geral, abordando tópicos como:
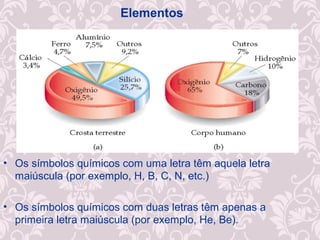
1) Definição de química como ciência que estuda a composição e propriedades das substâncias;
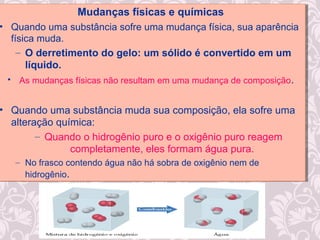
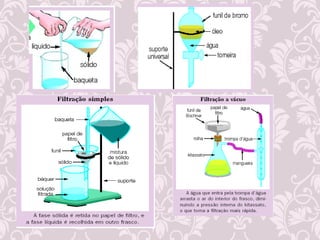
2) Diferença entre mudanças físicas e químicas;
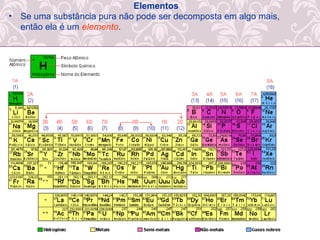
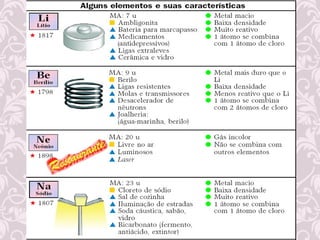
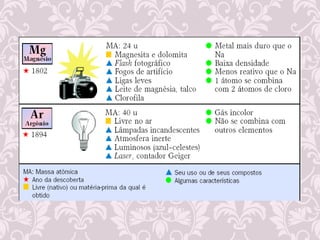
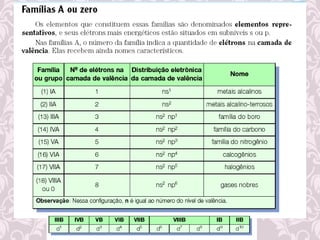
3) Desenvolvimento histórico dos modelos atômicos, incluindo as contribuições de Dalton, Thomson, Rutherford e Bohr.