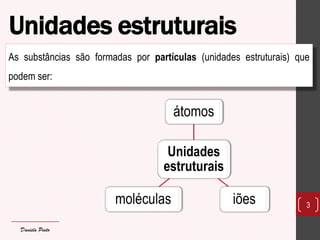
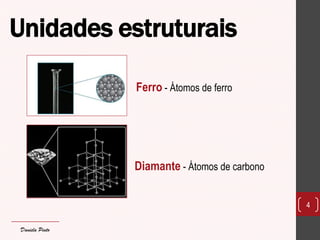
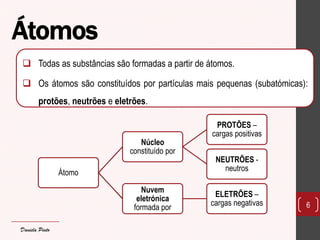
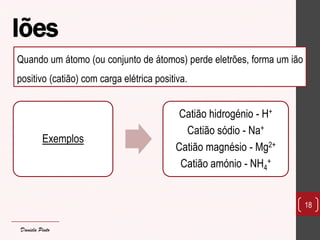
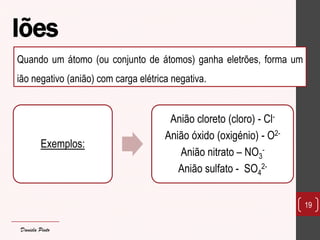
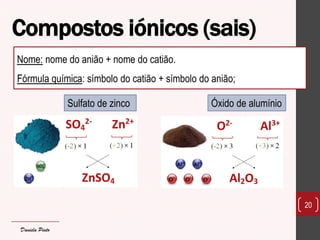
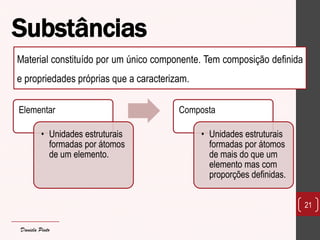
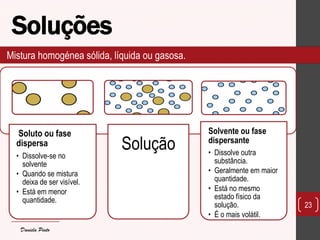
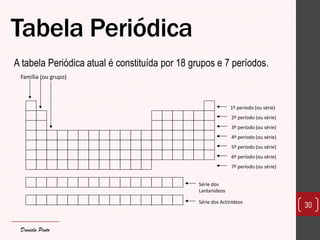
O documento discute os diferentes tipos de materiais, suas unidades estruturais e propriedades. Aborda átomos, iões, elementos químicos, isótopos, massa atômica, tabela periódica, compostos iônicos, soluções e concentração. Fornece exemplos de cada conceito discutido.