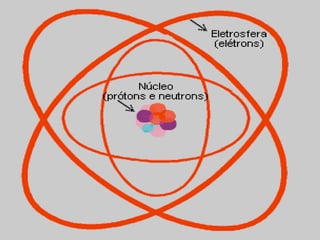
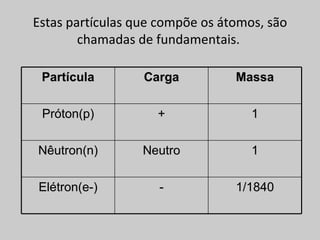
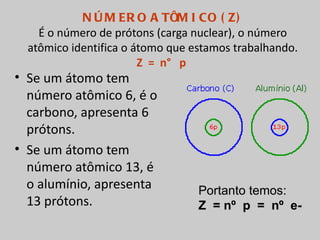
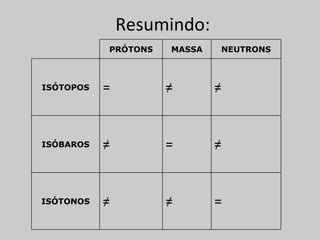
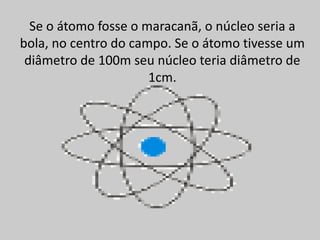
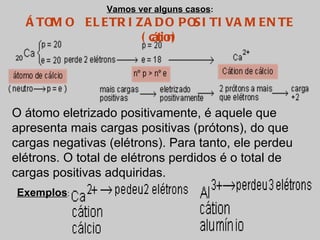
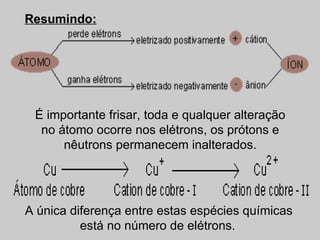
O documento explica os principais conceitos da estrutura atômica, incluindo: (1) Átomos são constituídos de um núcleo central com prótons e nêutrons, cercado por elétrons; (2) O número atômico define o elemento químico, enquanto isótopos e isóbaros variam em massa e nêutrons; (3) Íons são átomos que ganharam ou perderam elétrons, resultando em cargas positivas ou negativas.