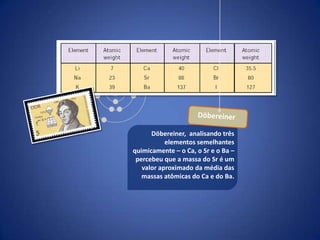
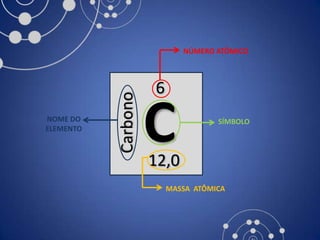
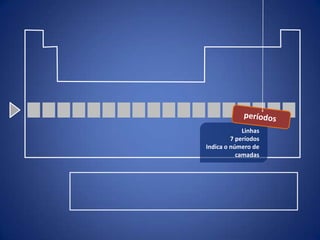
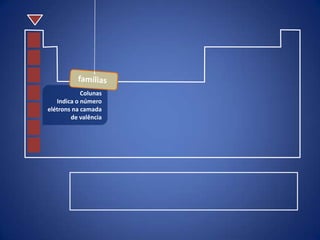
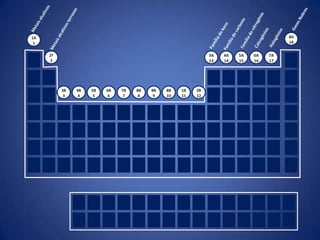
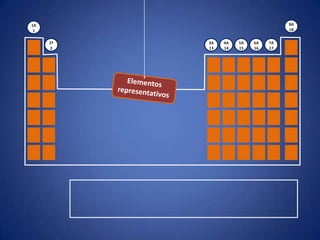
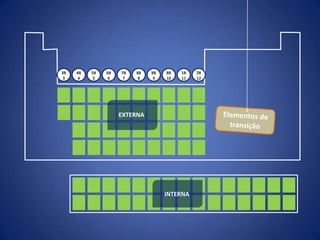
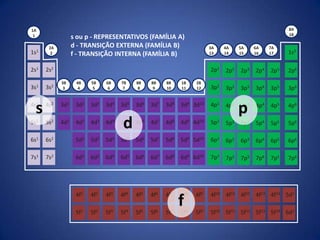
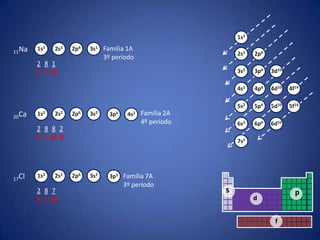
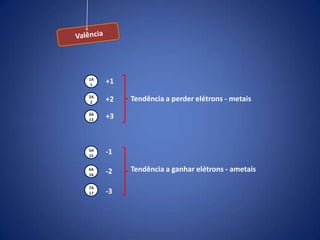
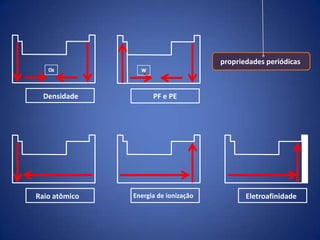
O documento resume a evolução histórica da tabela periódica dos elementos, desde as primeiras tentativas de organizá-los até a estrutura atual baseada no número atômico. Detalha contribuições de Dalton, Döbereiner, Newlands, Mendeleev e Moseley e como suas ideias levaram à compreensão das propriedades periódicas.