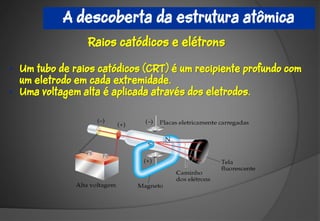
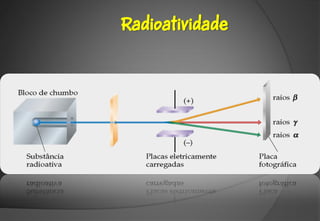
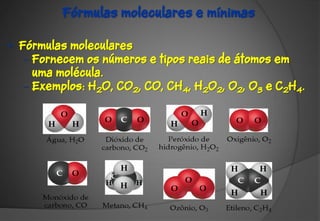
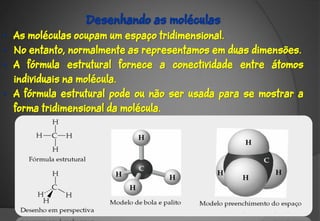
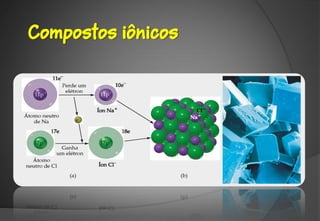
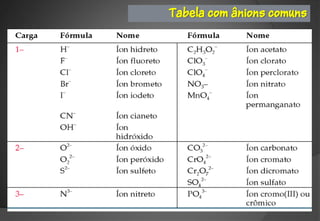
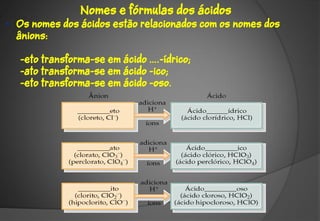
O documento discute a evolução da teoria atômica ao longo do tempo, desde os gregos antigos até os modelos atômicos modernos. Aborda os experimentos de Thomson, Rutherford e outros que levaram à descoberta da estrutura atômica, incluindo a existência de núcleo, prótons, elétrons e isótopos. Também explica conceitos como massa atômica, moléculas, íons, compostos iônicos e nomenclatura química.