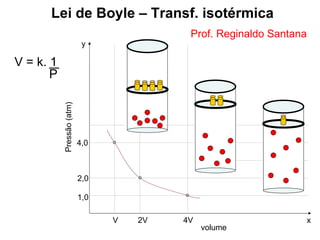
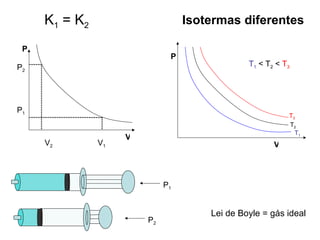
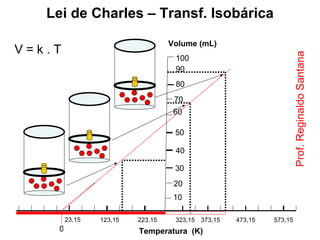
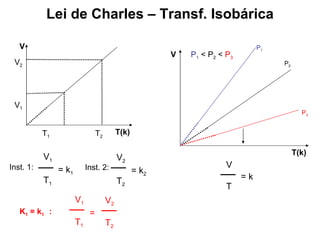
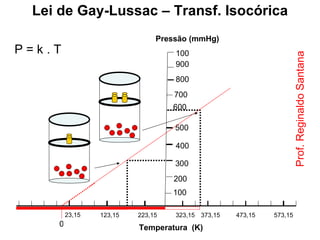
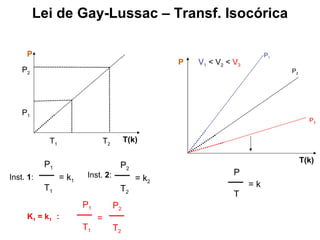
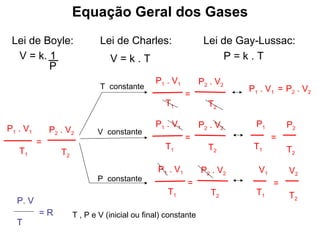
Este documento discute a teoria cinética dos gases. Explica que os gases são formados por moléculas com grande liberdade de movimento que colidem elasticamente. Apresenta as leis de Boyle, Charles e Gay-Lussac, que descrevem a relação entre pressão, volume e temperatura em gases ideais. Por fim, introduz a equação dos gases ideais relacionando essas variáveis à quantidade de gás e à constante dos gases ideais R.