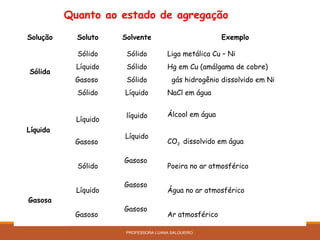
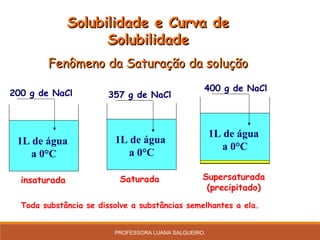
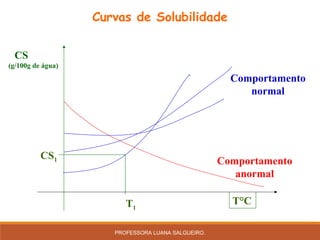
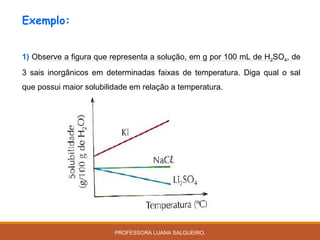
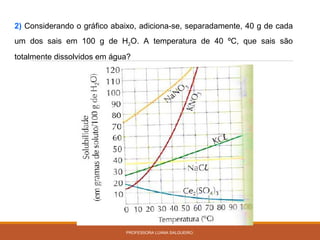
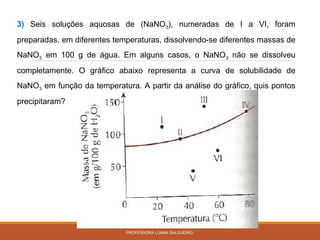
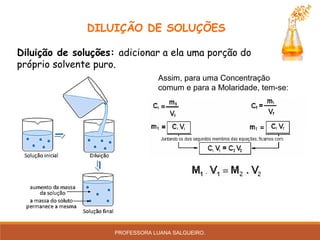
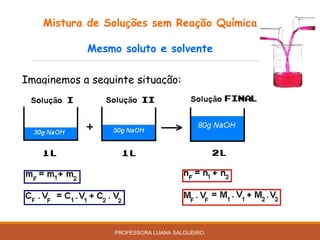
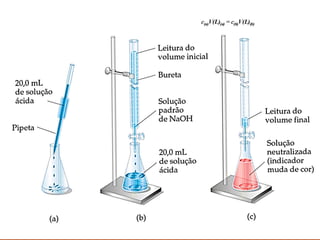
O documento discute conceitos sobre soluções e solubilidade, incluindo: 1) as definições de soluto, solvente e solução; 2) os diferentes tipos de soluções classificados pelo estado de agregação do soluto e solvente; 3) a classificação de soluções como iônicas ou moleculares; 4) os conceitos de solubilidade, curva de solubilidade e saturação de soluções; 5) exemplos e cálculos envolvendo concentração, titulação e diluição de soluções.