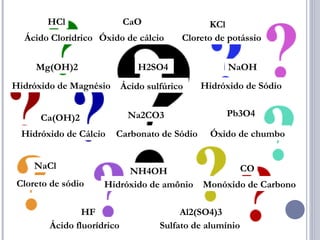
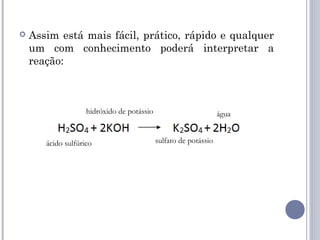
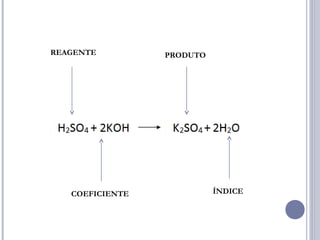
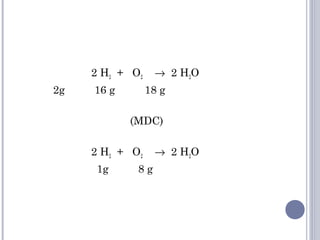
As quatro principais funções inorgânicas são ácidos, bases, sais e óxidos. Ácidos produzem íons hidrogênio quando dissolvidos em água, enquanto bases produzem íons hidróxido. Sais são compostos iônicos formados por um cátion e um ânion. Óxidos são compostos binários de um elemento e oxigênio.