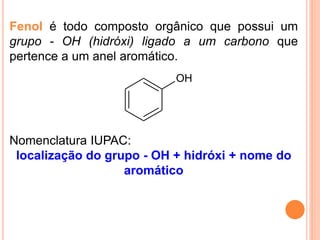
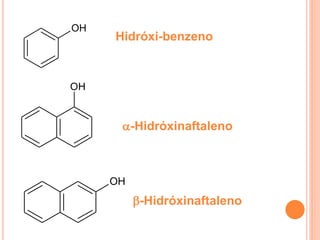
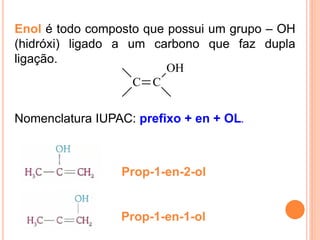
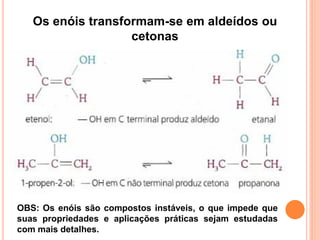
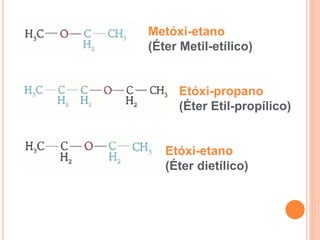
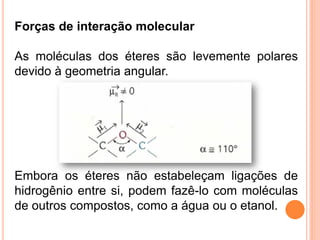
O documento descreve as características de fenóis, enóis e éteres. Fenóis contêm um grupo hidroxila ligado a um anel aromático. Enóis contêm um grupo hidroxila ligado a um carbono de dupla ligação. Éteres contêm oxigênio ligado entre dois carbonos. Todos formam ligações de hidrogênio, resultando em pontos de fusão e ebulição mais altos do que alcanos de massa similar.