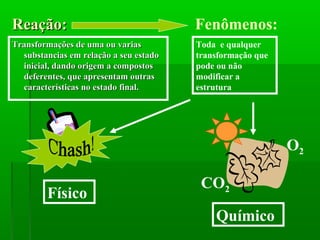
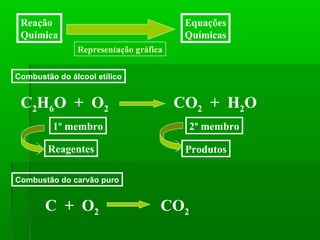
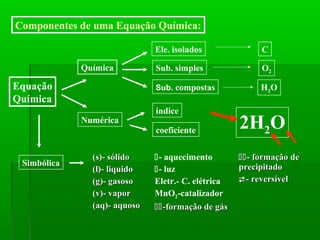
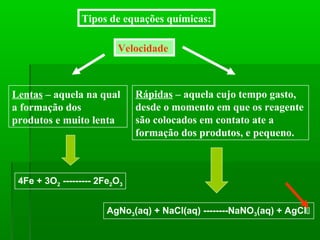
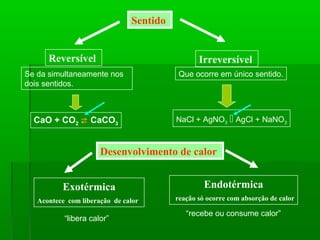
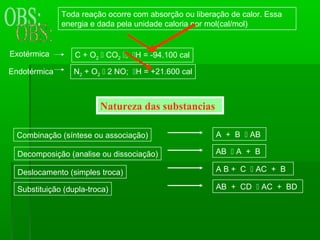
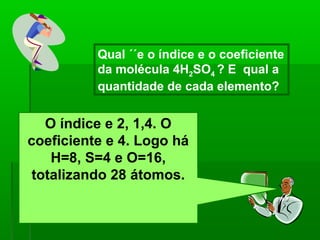
O documento discute reações químicas, incluindo seus componentes, tipos, equações e propriedades. É descrito que uma reação química envolve a transformação de substâncias em novos compostos, e exemplos de reações como combustão e dupla troca são apresentados. Equações químicas representam graficamente as reações através de índices, coeficientes e símbolos para reagentes e produtos.