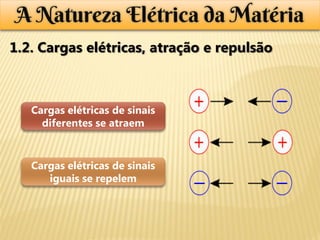
O documento descreve os principais modelos atômicos históricos, incluindo: 1) O modelo de Thomson, no qual o átomo é uma esfera de carga positiva com elétrons incrustados na superfície; 2) O modelo de Rutherford, no qual experimentos com partículas alfa mostraram que o átomo é principalmente vazio, com uma região densa e carregada positivamente no centro (o núcleo); 3) O modelo atual, no qual o núcleo contém prótons e nêutrons e é cercado